题目内容
20.石英与焦炭在高温的氮气流中发生可逆反应,能制得新型陶瓷材料氮化硅(Si3N4):SiO2(s)+C(s)+N2(g)$\stackrel{高温}{→}$Si3N4(s)+CO(g)(未配平)△H<0.下列叙述正确的是( )| A. | 该反应的氧化剂为N2,还原产物为CO | |
| B. | 反应中每生成0.1mol Si3N4转移电子的物质的量为1.2mol | |
| C. | 增大压强平衡向正反应方向移动 | |
| D. | 反应平衡常数表示为K=$\frac{c(CO)}{c({N}_{2})}$,升高温度K值增大 |
分析 由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:4,所以SiO2、C+、N2化学计量数之比为3:6:4,令SiO2的化学计量数为3,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2(s)+6C(s)+2N2(g) $\frac{\underline{\;高温\;}}{\;}$ Si3N4(s)+6CO(g)△H<0,
A、化合价升高元素所在的反应物为还原剂;被还原的结果是还原产物,被氧化的结果是氧化产物;
B、化学反应中转移的电子数目等于元素化合价升高或降低的数目;
C、增大压强,化学平衡向着气体体积减小的方向进行;
D、此反应的平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$,对于放热反应,升高温度,平衡常数减小.
解答 解:A、在氮化硅的合成反应中,氮元素的化合价由0价降低到-3价,所以氮气是氧化剂;碳元素的化合价升高,被氧化成CO,CO是氧化产物,故A错误;
B、氮元素的化合价总共降低了4×(3-0)=12价,所以每生成1molSi3N4,N2得到12mol电子,当生成0.1mol Si3N4时转移电子的物质的量为1.2mol,故B正确;
C、增大压强,化学平衡向着气体体积减小的方向进行,即向着逆向进行,故C错误;
D、此反应的平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$,对于放热反应,升高温度,平衡常数减小,故D错误;
故选B.
点评 本题考查学生有关氧化还原反应中的有关概念、电子转移以及化学平衡常数随温度的变化的知识,配平方程式是解题的关键,综合性较强.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列关于有机物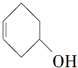 的叙述不正确的是( )
的叙述不正确的是( )
 的叙述不正确的是( )
的叙述不正确的是( )| A. | 与HBr、溴水发生加成反应,产物都只有一种 | |
| B. | 分子式为C6H10O | |
| C. | 可发生加成、酯化和氧化反应 | |
| D. | 分子中有两种官能团 |
11.如表为元素周期表的一部分,已列出10种元素在周期表中的位置.按要求回答下列问题.
(1)10种元素中,形成气态氢化物最稳定的是F元素(填元素符号).
(2)⑥的最高价的氧化物与氢氧化钠反应的化学方程式为GeO2+2NaOH=Na2GeO3+H2O.
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)O2->Na+>Mg2+>Al3+.
(4)④、⑦元素形成的氢化物中,沸点较高的是H2O,理由是水分子间存在氢键常温下水为液态,S的氢化物分子间无氢键,常温下为气态.
(5)用一个实验事实(或一个化学方程式)证明④、⑨元素的非金属性更强的是⑨:用氯气将硫化钠溶液中的硫离子氧化成硫单质,Cl2+Na2S=2NaCl+S↓,产生黄色沉淀.
(6)用电子式表示③⑧形成化合物的过程 .
.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑦ | ⑧ | ||||||
| 第3周期 | ① | ③ | ⑤ | ④ | ⑨ | ⑩ | ||
| 第4周期 | ② | ⑥ |
(2)⑥的最高价的氧化物与氢氧化钠反应的化学方程式为GeO2+2NaOH=Na2GeO3+H2O.
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)O2->Na+>Mg2+>Al3+.
(4)④、⑦元素形成的氢化物中,沸点较高的是H2O,理由是水分子间存在氢键常温下水为液态,S的氢化物分子间无氢键,常温下为气态.
(5)用一个实验事实(或一个化学方程式)证明④、⑨元素的非金属性更强的是⑨:用氯气将硫化钠溶液中的硫离子氧化成硫单质,Cl2+Na2S=2NaCl+S↓,产生黄色沉淀.
(6)用电子式表示③⑧形成化合物的过程
 .
.
8.下列气体不能用来做喷泉实验的是( )
| A. | HCl | B. | NO | C. | SO2 | D. | NH3 |
15.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热需要看反应物和生产物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应都伴随能量变化,而且都表现为热量变化 |
5.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 12.5mL 16mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA | |
| B. | 1.8gNH4+与2.3gNa+所含电子数目均为NA | |
| C. | 7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA | |
| D. | 常温常压下,92 gNO2和N2O4混合气体含有的原子数为6NA |
12.除去铁粉中的少量铝粉,可以选用下列哪种溶液( )
| A. | 盐酸 | B. | 硝酸 | C. | 硫酸 | D. | 氢氧化钠溶液 |