题目内容
15.下列说法正确的是( )| A. | 需要加热的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热需要看反应物和生产物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应都伴随能量变化,而且都表现为热量变化 |
分析 A.某些放热反应也需要加热才能发生,吸热反应不需要加热也可以发生反应;
B.生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反;
C.放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生;
D.化学反应的能量变化可以是热能、光能、电能等.
解答 解:A.某些放热反应也需要加热才能发生,如铝热剂发生的反应是放热反应,需要加热发生反应,吸热反应不需要加热也可以发生反应,如氢氧化钡晶体和氯化铵的反应为吸热反应,常温下能发生反应,故A错误;
B.生成物的总能量低于反应物总能量的反应,是放热反应,若是吸热反应则相反,所以反应是放热还是吸热取决于反应物和生成物的总能量的相对大小,故B正确;
C.放热反应在常温下不一定很容易发生,如碳与氧气的反应为放热反应,但须点燃,故C错误;
D.化学反应的能量变化可以是热能、光能、电能等等,不仅仅是热能,故D错误;
故选B.
点评 本题考查了化学反应中能量变化的形式、焓变与反应条件无关,注意基础知识的积累,题目难度不大.

练习册系列答案
相关题目
6. 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如表对比实验:
(l)请完成以下实验设计表1(表中不要留空格)
表1
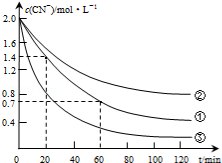
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
表2
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如表对比实验:
(l)请完成以下实验设计表1(表中不要留空格)
表1
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
表2
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
10.下列微粒中,属于阴离子的是( )
| A. | 含11个质子、12个中子、10个电子的粒子 | |
| B. | 含18个质子、22个中子、18个电子的粒子 | |
| C. | 含17个质子、18个中子、17个电子的粒子 | |
| D. | 含17个质子、20个中子、18个电子的粒子 |
20.石英与焦炭在高温的氮气流中发生可逆反应,能制得新型陶瓷材料氮化硅(Si3N4):SiO2(s)+C(s)+N2(g)$\stackrel{高温}{→}$Si3N4(s)+CO(g)(未配平)△H<0.下列叙述正确的是( )
| A. | 该反应的氧化剂为N2,还原产物为CO | |
| B. | 反应中每生成0.1mol Si3N4转移电子的物质的量为1.2mol | |
| C. | 增大压强平衡向正反应方向移动 | |
| D. | 反应平衡常数表示为K=$\frac{c(CO)}{c({N}_{2})}$,升高温度K值增大 |
7.下列除去杂质的实验方法不正确的是( )
| A. | 除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去氧化铝中混有的少量二氧化硅,用足量的稀盐酸溶解后过滤 | |
| D. | 除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2 |
15.下列说法不正确的是( )
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 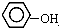 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源. (任写一种).
(任写一种).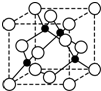 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: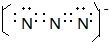 ;
;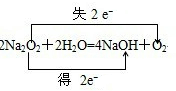 ;
;