题目内容
7. 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.(1)①N2(g)+O2(g)═2NO(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
③C(s)+O2(g)═CO2(g)△H3
则2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2△H3-△H1-△H2(用△H1、△H2、△H3表示)
(2)工业上常用醋酸二氨合亚铜[Cu(NH3) 2]AC溶液(AC为CH3COO-)来吸收某合成气中的CO,其反应为:[Cu(NH3) 2]AC(aq)+NH3(g)+CO(g)?[Cu(NH3)3]AC•CO(aq)△H<0
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2]AC溶液的措施是加热;
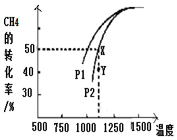
(3)用天然气制取H2的其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g). 在密闭容器中通入物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1小于P2(填“大于”或“小于”),理由是温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小;压强为P2时,在Y点:v(正)大于 v(逆)(填“大于”、“小于”或“等于”).
(4)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离平衡常数Ka=9.6×10-4,NaNO2溶液中存在平衡NO2-+H2O?HNO2+OH-Kh=5.0×10-11则该温度下水的离子积常数KW=4.8×10-14.
分析 (1)①N2(g)+O2(g)═2NO(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
③C(s)+O2(g)═CO2(g)△H3,2×③-①-②得,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2△H3-△H1-△H2,据此进行分析;
(2)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(3)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小;Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡;
(4)依据亚硝酸根离子水解平衡常数表达式变式计算分析.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H1
②2C(s)+O2(g)═2CO(g)△H2
③C(s)+O2(g)═CO2(g)△H3,2×③-①-②得,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=2△H3-△H1-△H2,
故答案为:2△H3-△H1-△H2;
(2)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC,
故答案为:加热;
(3)温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小,故压强P1<P2;理由是温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小;Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡,则v(正)>v(逆),
故答案为:小于;温度一定时,正反应是气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即逆向移动,甲烷的转化率减小;大于;
(4)NO2-+H2O?HNO2+OH-,Kh=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$,则Kw=Kh×Ka=5.0×10-11mol•L-1×9.6×10-4mol•L-1=4.8×10-14,
故答案为:4.8×10-14.
点评 本题考查了反应热的计算、化学平衡的调控作用、影响平衡移动及离子积常数的计算,注意知识的归纳和整理是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
| A. | 1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| C. | 水中的钢闸门连接电源的负极,属于外加电流的阴极保护法 | |
| D. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
I.实验前首先用浓度为 0.1000mol/L 酸性 KMnO4标准溶液滴定未知浓度的草酸溶液.
(1)写出滴定过程中发生反应的离子方程式 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 C.
A.把 15.8g KMnO4固体溶于 1L 水中所得溶液物质的量浓度为 0.1mol/L
B.把 0.01mol KMnO4固体投入 100mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1mol/L C.需要 90mL 0.1mol/L 的 KMnO4溶液,应准确称量 KMnO4 固体 1 58g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000mol/L.用该草酸溶液按下表进行后续实验(每次实验草酸溶液 的用量均为 8.00mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
越快”的结论.甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到 了 错 误 的 实 验 结 论,甲 同 学 改 进 了 实 验 方 案,请 简 述 甲 同 学 改 进.
(5)该实验中使用的催化剂应选择 MnSO4并非 MnCl2,原因可用离子方程式表示为 2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾.
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入 CO2 可获得高锰酸钾.
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(7)向锰酸钾溶液中通入CO2可获得高锰酸该反应中氧化产物与还原产物的物质的量之比为2:1.
| A. | 铁在熔融状态下能导电,所以铁是电解质 | |
| B. | 氯化氢在熔融状态下不导电,所以氯化氢是非电解质 | |
| C. | 氯气的水溶液能导电,所以氯气是电解质 | |
| D. | 电解质和非电解质都是纯净物 |
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 长期露置于潮湿空气中的Fe粉中加入足量的稀盐酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀盐酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入浓硝酸中 | 无现象 | Al在浓硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上 | 试纸变红色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,第三周期元素氢化物稳定性:HCl>H2S | |
| C. | ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.