题目内容
常温下,下列各组离子在指定条件下一定能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-
B.无色溶液中:Al3+、NH4+、Cl-、HCO3-
C.pH=1的溶液中:ClO-、SO42-、Fe2+、K+
D.由水电离的c(OH-)=10-14mol· L-1的溶液中:CH3COO-、SO42-、Na+、NH4+
练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
3.某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯1种物质中1种或几种,在鉴别时有下列现象:(1)有银镜反应;(2)加入新制Cu(OH)2悬浊液沉淀不溶解;(3)与含酚酞的NaOH溶液共热发现溶液中红色逐渐消失以至无色,下列叙述正确的有( )
| A. | 几种物质都有 | B. | 有甲酸乙酯,可能有甲酸 | ||
| C. | 有甲酸乙酯和甲醇 | D. | 有甲酸乙酯,可能有甲醇 |
10.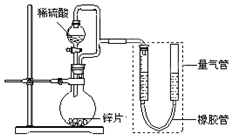 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是Zn+2H+=Zn2++H2↑.
②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2
比较实验Ⅰ和Ⅱ可以得出的实验结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是abc(填序号).
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度.
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为$\frac{65V}{22.4m}$×100%.
②本实验在读数前对量气管的操作是调整左右两管的液面高度相平,且视线与液面相平.
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将.无影响(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用c(填序号).
NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是Zn+2H+=Zn2++H2↑.
②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是abc(填序号).
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度.
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为$\frac{65V}{22.4m}$×100%.
②本实验在读数前对量气管的操作是调整左右两管的液面高度相平,且视线与液面相平.
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将.无影响(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用c(填序号).
NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
8.某气态烷烃和气态单烯烃组成的混合气体在同温同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L通入足量溴水中,溴水增重2.8g,此两种烃是( )
| A. | 甲烷和丙烯 | B. | 乙烷和2-丁烯 | ||
| C. | 甲烷和2-甲基丙烯 | D. | 乙烯和1-丁烯 |


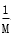 g C.
g C. 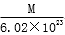 g D.
g D. 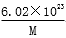 g
g bZ(g),反应达到平衡后,测得X的转化
bZ(g),反应达到平衡后,测得X的转化 率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.