题目内容
20.有机物的结构可用“键线式”表示.如CH3-CH═CH-CH3,可简写为 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为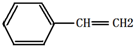 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
分析 根据有机物结构简式可确定有机物分子式,有机物含有碳碳双键,可发生加成、加聚和氧化反应,结合位置异构判断同分异构体,以此来解答.
解答 解:A.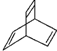 分子中含有8个碳原子和8个氢原子,其分子式为C8H8,故A正确;
分子中含有8个碳原子和8个氢原子,其分子式为C8H8,故A正确;
B. 的分子式为C8H8,Y中含有苯环,Y的支链含有2个碳原子和3个氢原子,则Y的结构简式为
的分子式为C8H8,Y中含有苯环,Y的支链含有2个碳原子和3个氢原子,则Y的结构简式为 ,故B正确;
,故B正确;
C.含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,故C正确;
D.Z中心对称,并且镜面对称,所以角上一种,“Y“型交叉点一种,共有两种类型的氢原子,则Z的一氯代物有2种,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意把握有机物的官能团的性质,注意把握同分异构体的判断,答题时注意审题.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L空气中含单质气体的分子数为NA | |
| B. | 1L0.5mol•L-1FeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶体 | |
| C. | NA个N2分子所占的体积与0.5NA个H2分子所占的体枳比为2:1 | |
| D. | 2.3gNa完全与O2反应生成Na2O,失去的电子数为0.1NA |
11.20mL由两种气态烃组成的混合物,和足量的O2完全燃烧生成了50mLH2O(g)和40mL CO2(在同温同压下测定).该混合物可能由下列哪两种烃组成的( )
| A. | C2H2、C2H4 | B. | C2H6、C2H8 | C. | C2H4、C4H8 | D. | CH4、C3H6 |
8.不能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入可溶性硅酸盐中析出硅酸沉淀 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 |
15.如图是某同学设计的原电池装置,下列叙述中正确的是( )


| A. | 氧化剂和还原剂必须直接接触才能发生反应 | |
| B. | 电极Ⅱ上发生还原反应,做原电池的正极 | |
| C. | 该原电池的总反应式为2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 盐桥中装有含氯化钾的琼脂,K+移向负极区 |
5.把镁条、铝条平行插入一定浓度的NaOH溶液中,用导线连接成原电池,此电池工作时,下列叙述中正确的是( )
| A. | Mg比Al活泼,Mg失去电子被氧化为Mg2+ | |
| B. | 负极反应式为Al-3e-+4OH-═AlO2-+2H2O | |
| C. | 原电池工作过程中溶液pH不变 | |
| D. | Al是电池正极,开始工作时溶液中会立即有白色沉淀析出 |
12.某离子晶体的晶胞为正三棱柱(如图所示),该晶体中A、B、C三种微粒的数目之比为( )


| A. | 3:9:4 | B. | 1:4:2 | C. | 6:9:1 | D. | 3:8:4 |
12.在一定温度下,向密闭容器中加入一定量CH3OH,发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)能判断该反应已达到平衡状态的依据是( )
| A. | 容器中压强不变 | |
| B. | 混合气体中$\frac{n(C{H}_{3}OC{H}_{3})}{n({H}_{2}O)}$的比值保持不变 | |
| C. | v生成(CH3OH)=2v消耗(H2O) | |
| D. | c生成(CH3OCH3)=c消耗(H2O) |