题目内容
12.某离子晶体的晶胞为正三棱柱(如图所示),该晶体中A、B、C三种微粒的数目之比为( )
| A. | 3:9:4 | B. | 1:4:2 | C. | 6:9:1 | D. | 3:8:4 |
分析 晶体的部分结构为正三棱柱,根据分摊法知顶角有$\frac{1}{12}$的A属于该晶胞,侧棱上的B有$\frac{1}{6}$属于该晶胞,位于上下底面边上的B有$\frac{1}{4}$属于该晶胞,含C原子个数为1,以此解答该题.
解答 解:A位于正三棱柱的顶角,则有$\frac{1}{12}$的A属于该晶胞,该晶胞中含A的个数为6×$\frac{1}{12}$=$\frac{1}{2}$,B分为两类,位于侧棱上的B有$\frac{1}{6}$属于该晶胞,位于上下底面边上的B有$\frac{1}{4}$属于该晶胞,该晶胞含B原子个数为3×$\frac{1}{6}$+6×$\frac{1}{4}$=2,含C原子个数为1,则A、B、C三种原子个数之比为$\frac{1}{2}$:2:1=1:4:2,
故选B.
点评 本题考查晶胞的计算,为高频考点,侧重考查学生空间想象能力及计算能力,明确每个粒子被几个晶胞占有是解本题关键,题目难度不大.

练习册系列答案
相关题目
2.在下列溶液中分别通入足量的CO2,最终产生沉淀的是( )
| A. | 氯化钙 | B. | 氢氧化钙 | C. | 氯化钠 | D. | 偏铝酸钠 |
3.钚是一种具有放射性的超铀元素,几位美国科学家在1940年首次发现这一元素,它目前被应用于核武器和核反应堆.下列说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu、${\;}_{94}^{239}$Pu和${\;}_{94}^{240}$Pu是钚的三种同素异形体 | |
| B. | ${\;}_{94}^{238}$Pu中有94个中子 | |
| C. | ${\;}_{94}^{239}$Pu的中子数与质子数之差为51 | |
| D. | 一个${\;}_{94}^{240}$Pu的质量为240 g |
20.有机物的结构可用“键线式”表示.如CH3-CH═CH-CH3,可简写为 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为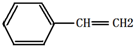 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
7.化合物A分子式为C8H8O2分子中苯环(C6H5-)上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是( )


| A. | 核磁共振氢谱数据在推理A的结构式时用处不大 | |
| B. | A的结构式可表示为C6H5-COOH | |
| C. | 符合题中A分子结构特征的有机物有2种 | |
| D. | 碥定A的分子结构还需要实验数据 |
17.下列各组物质互为同素异形体的是( )
| A. | H、D和T | B. | 甲烷与丙烷 | C. | 乙醇与二甲醚 | D. | 红磷与白磷 |
4.有四种短周期主族元素分别为X、Y、Z、W.X是地壳中含量最多的元素; Y元素的单质是空气的主要成分之一;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W元素的最高正价和最低负价的代数和为0.下列说法正确的是( )
| A. | 原子半径:X<Y<W<Z | |
| B. | Z的氧化物一定只有一种 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
1.以菱镁矿(主要成分为MgCO3、含少置FeCO3、SiO2)制备高纯氧化镁的流程如图所示:

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如表一、二:
表一:
表二:
(1)操作 II和 III中涉及的分离方法分别是过滤、蒸发、结晶、过滤.
(2)残渣I的主要成分是,加入H2O2的过程中可观察到的现象是溶液变为黄色,有气泡生成,其中发生的离子反应方程式是H2O2+2Fe2++2H+=2Fe3++2H2O.
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收.煅烧时发生反应的化学方程式是2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+CO2↑+2SO2↑.
(4)采用滴定法测定溶液 II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失.实验中应选取
指示剂,加入氨水是为了沉淀溶液 II中的Fe3+ 离子,若终点时该离子浓度=1.0×10-5mol•L-1,则溶液 III的 pH=3.2(己知:lg2=0.3).

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如表一、二:
表一:
| 指示剂 | 酚酞 | 甲基酸 |
| 变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.1 | 5.9 | 8.4 |
| 沉淀完全时pH | 3.? | 9.? | 10.2 |
| 溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(2)残渣I的主要成分是,加入H2O2的过程中可观察到的现象是溶液变为黄色,有气泡生成,其中发生的离子反应方程式是H2O2+2Fe2++2H+=2Fe3++2H2O.
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收.煅烧时发生反应的化学方程式是2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+CO2↑+2SO2↑.
(4)采用滴定法测定溶液 II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失.实验中应选取
指示剂,加入氨水是为了沉淀溶液 II中的Fe3+ 离子,若终点时该离子浓度=1.0×10-5mol•L-1,则溶液 III的 pH=3.2(己知:lg2=0.3).
4.已知1mol某烃X能与2molCl2完全加成得到Y,1molY能与4molC12 完全取代得到物质Z,则X 的结构简式可能是( )
| A. | CH2=CH2 | B. | CH≡CH | ||
| C. | CH≡CCH 3 | D. | CH2=CCl一CH=CHCl |