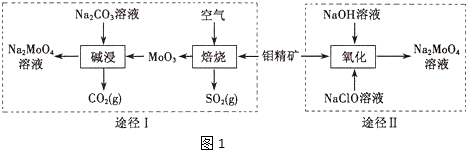
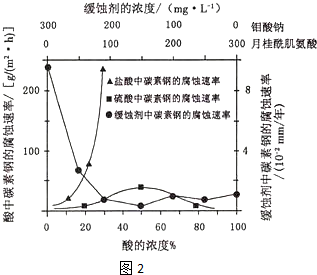
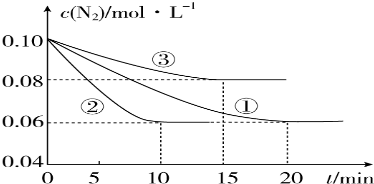
题目内容
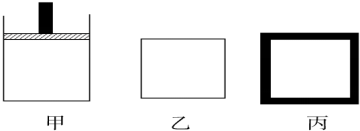
2.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下: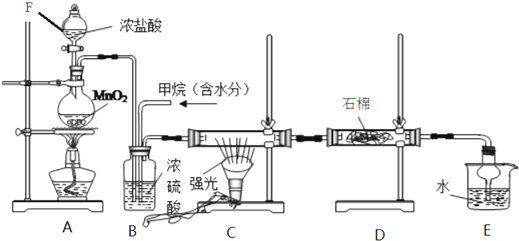
根据要求填空:
(1)进行实验之前必须进行的操作是装置气密性检查.
(2)反应开始进行时不应该(填应该或不应该)将F中的浓盐酸一次性加入烧瓶.写出C装置中发生的化学反应方程式CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl.
(3)B装置有三种功能:①控制气流速度;②使气体混合均匀;③干燥气体.
(4)E装置的作用是CD(填编号)
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)设$\frac{V(C{l}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x的取值范围是≥4.
(6)装置E中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液,该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是AB(填编号).
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4.
(7)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是除去过量的氯气.
分析 装置A中用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经装置B中的浓硫酸干燥后,进入装置C中,和装置B中通入的甲烷在光照条件下在装置C中发生取代反应,生成多种氯代烃和HCl,发生的反应有CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,氯气具有强氧化性,能将碘化钾氧化为碘单质,通过装置D中石棉上的KI吸收氯气,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)有连接的实验装置在实验前必须检验装置气密性;
(2)反应开始进行浓盐酸在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒为炭黑,说明有碳生成;
(3)B装置中甲烷和氯气在此处混合,且浓硫酸具有吸水性;
(4)E装置中盛有水,水能吸收HCl,且倒置的干燥管能防止倒吸;
(5)氯气的物质的量越多,甲烷的转化率越大;
(6)互不相溶的液体采用分液方法分离;该装置中气体除了HCl外还有甲烷和一氯甲烷;
(7)氯气具有强氧化性,能氧化KI生成碘.
解答 解:装置A中用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经装置B中的浓硫酸干燥后,进入装置C中,和装置B中通入的甲烷在光照条件下在装置C中发生取代反应,生成多种氯代烃和HCl,发生的反应有CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,氯气具有强氧化性,能将碘化钾氧化为碘单质,通过装置D中石棉上的KI吸收氯气,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)有连接的实验装置在实验前必须检验装置气密性,否则可能无法实现实验目的,故答案为:检验装置气密性;
(2)CH4与Cl2在强光照射下生成的四氯甲烷和氯化氢等,可发生CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,
故答案为:CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl;
(3)B装置中甲烷和氯气在此处混合而使气体混合均匀,且浓硫酸具有吸水性,能干燥气体,
故答案为:使气体混合均匀;干燥气体;
(4)E装置中盛有水,水能吸收HCl,HCl能污染空气,所以E的作用是吸收HCl,且倒置的干燥管能防止倒吸,故答案为:CD;
(5)氯气的物质的量越多,甲烷的转化率越大,则理论上欲获得最多的氯化氢,x的取值范围是≥4,
故答案为:≥4;
(6)互不相溶的液体采用分液方法分离,所以装置E中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液;该装置中气体除了HCl外还有甲烷和一氯甲烷,为防止污染空气,应该有尾气处理装置,
故答案为:分液;AB;
(7)氯气具有强氧化性,能氧化KI生成碘,从而除去氯气,故答案为:除去过量的氯气.
点评 本题考查物质制备,为高频考点,明确甲烷发生取代反应的原理是解本题关键,知道各个装置的作用,会对装置进行实验评价,题目难度不大.

 名校课堂系列答案
名校课堂系列答案(1)滴定:用酸式滴定管盛装c mol/L盐酸标准液.实验中选用酚酞作指示剂,当滴入最后一滴盐酸时,溶液由红色变为无色、且半分钟内不变色现象时表示滴定达到终点.实验有关数据记录如下:
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果无影响;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果偏低.
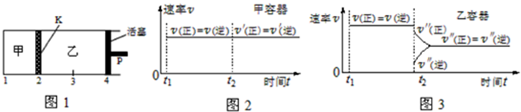
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
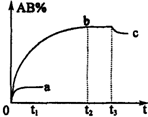 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |