题目内容
7.工业制硫酸的核心反应是:2SO2(g)+O2(g)?2SO3(g)△H<0,(1)此反应的平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$.
(2)将一定量的SO2(g) 和O2(g) 放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.12mol,O2为0.05mol,SO3为0.12mol.计算该条件下,反应的平衡常数K=20.SO2的转化率=50%.
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是AC(填字母).
A.通入氧气 B.升高温度 C.增大压强 D.减小压强 E.加入催化剂.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)依据平衡常数表达式,计算化学平衡常数;
(3)依据平衡移动原理,分析SO2的转化率.
解答 解:(1)反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(2)该条件下,反应的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.1{2}^{2}}{0.1{2}^{2}×0.05}$=20;根据反应2SO2(g)+O2(g)?2SO3(g)可知,生成0.12mol三氧化硫需要消耗0.12mol二氧化硫,则反应前二氧化硫的总物质的量为:0.12mol+0.12mol=0.24mol,所以二氧化硫的转化率为:$\frac{0.12mol}{0.24mol}$×100%=50%,
故答案为:20;50%;
(3)A.通入氧气,化学平衡性质正向移动,则SO2的转化率增大,故A正确;
B.移出氧气,化学平衡性质逆向移动,SO2的转化率减小,故B错误;
C.增大压强,平衡向着正向移动,SO2的转化率增大,故C正确;
D.减小压强,平衡向着逆向移动,SO2的转化率减小,故D错误;
E.加入催化剂,化学平衡不移动,SO2的转化率不变,故E错误;
故答案为:AC.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数、转化率的计算、化学平衡及其影响等知识,明确化学平衡常数、转化率的概念即可解答,试题培养了学生的分析能力及化学计算能力.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案| A. | 2.0g重水(D2O)中含有的中子数为NA | |
| B. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| C. | 23g金属钠变为钠离子时失去的电子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
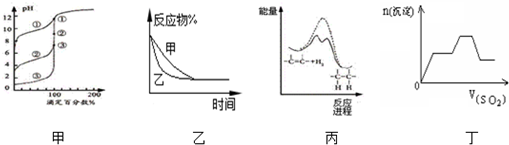
| A. | 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图甲曲线确定①的酸性最强 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 由图丙可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 | |
| D. | 图丁是足量的SO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入SO2的量的关系图 |
| A. | 都是稳定的液体 | B. | 都是透明的液体 | C. | 都是混合物 | D. | 都有丁达尔效应 |
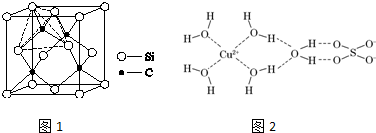
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
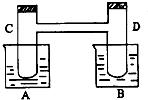 如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)
如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)