题目内容
将一小快金属钠投入到盛放FeCl2溶液的烧杯中,观察到的现象是 有关的离子方程式是 .
考点:钠的化学性质
专题:金属概论与碱元素
分析:钠的密度小于水,熔点较低,且钠和水剧烈反应生成氢氧化钠和氢气,氢氧化钠和氯化亚铁反应生成氢氧化亚铁白色沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁红褐色沉淀.
解答:
解:钠的密度小于水,所以钠会浮在水面上,钠的熔点较低,钠和水反应放出大量的热,而使钠熔成小球,钠和水反应放出的氢气使钠受力不均,导致钠四处游动,且放出嘶嘶的声音,钠和水反应生成氢氧化钠,氢氧化钠和氯化亚铁溶液反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,易被空气中氧气氧化生成红褐色沉淀氢氧化铁,所以看到的现象是:钠熔化成小球四处游动并发出嘶嘶的声音,有气泡产生,开始有白色沉淀,后迅速变成灰绿色,最后变成红褐色沉淀;
反应方程式为:2Na+2H2O=2Na++2OH-+H2↑、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:钠熔化成小球四处游动并发出嘶嘶的声音,有气泡产生,开始有白色沉淀,后迅速变成灰绿色,最后变成红褐色沉淀;2Na+2H2O=2Na++2OH-+H2↑、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
反应方程式为:2Na+2H2O=2Na++2OH-+H2↑、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:钠熔化成小球四处游动并发出嘶嘶的声音,有气泡产生,开始有白色沉淀,后迅速变成灰绿色,最后变成红褐色沉淀;2Na+2H2O=2Na++2OH-+H2↑、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
点评:本题考查了钠的性质,根据钠的物理性质、化学性质及氢氧化钠和氯化亚铁之间的复分解反应来分析解答,会运用化学语言解释反应现象,为易错点.

练习册系列答案
相关题目
下列六种物质:①Na20 ②Na202③CaCl2溶液④Na2C03溶液⑤NaOH ⑥NaHC03中,不能与二氧化碳反应的是( )
| A、①④ | B、②③ | C、③⑥ | D、③④⑥ |
已研制出的臭鼬剂主要成分是丁硫醇(C4H9SH),人的口臭是由于分泌出有臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH).下列说法不正确的是( )
| A、丁硫醇与甲硫醇及乙硫醇互为同系物 |
| B、沸点不同的丁硫醇有四种 |
| C、甲硫醇分子中含有四个共价键 |
| D、丁硫醇在空气中完全燃烧生成三氧化硫、二氧化碳和水 |
与普通玻璃成分相同的是( )
| A、有色玻璃 | B、钢化玻璃 |
| C、光学玻璃 | D、石英玻璃 |
下列说法不正确的是( )
| A、增大压强,活化分子百分数不变,化学反应速率增大 |
| B、升高温度,活化分子百分数增大,化学反应速率增大 |
| C、加入反应物,活化分子百分数增大,化学反应速率增大 |
| D、使用催化剂,活化分子百分数增大,化学反应速率增大 |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,下列说法错误的是( )
| A、通甲烷的一极为负极,通氧气的一极为正极 |
| B、放电时通入氧气的一极附近溶液的pH升高 |
| C、放电一段时间后,K+的物质的量不变 |
| D、通甲烷的电极反应式是:CH4+8OH--8e-═CO2+6H2O |
铁、钴、镍的原子序数分别为26、27、28,它们的性质相似,被称为铁系元素.已知反应Fe2O3+6HCl=2FeCl3+3H2O,Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,则下列物质的氧化能力由强到弱的顺序是( )
| A、Fe2O3>Co2O3>Cl2 |
| B、Cl2>Fe2O3>Co2O3 |
| C、Cl2>Co2O3>Fe2O3 |
| D、Co2O3>Cl2>Fe2O3 |
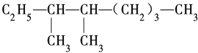 的系统命名法名称是
的系统命名法名称是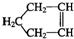 可简写为
可简写为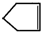 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: