题目内容
4.计算45g氮气在标准状况下所占的体积是多少升?[M(N2)=28g•mol-1].分析 结合n=$\frac{m}{M}$=$\frac{V}{Vm}$计算.
解答 解:n(N2)=$\frac{45g}{28g/mol}$=1.6mol,V(N2)=0.16mol×22.4L/mol=35.84L,
答:45g氮气在标准状况下所占的体积是35.84L.
点评 本题考查物质量的计算,侧重于学生的计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
14.二氧化碳的回收利用是环保领域研究热点.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是缩小容器体积.该温度下0~10min内H2的反应速率为0.06mol•L-1•min-1.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
15.某小组为研究电化学原理,设计了如图所示的电化学装置,电极Ⅰ为锌,其他电极均为石墨盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液,下列叙述正确的是( )
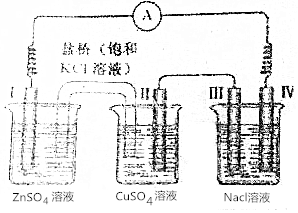

| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
12.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒的运动是有规律的,胶体中分散质微粒的运动是布朗运动 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光路 |
19.化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列操作不是围绕上述问题的是( )
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |
13.短周期主族元素A、B,C、D的原子序数依次增大.A是周期表中原子半径最小的元素,B是周期期表中能形成化合物最多的元素,C2-和D3+离子的电子层结构相同.下列说法正确的是( )
| A. | 氢化物的稳定:B>C | |
| B. | 简单离子的半径:D>C | |
| C. | 最高氧化物对应的水化物的酸性:B>D | |
| D. | BC2、D2C3中化学键类型相冋 |
14.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0.一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,c(Z)=0.24 mol•L-1 | |
| D. | 该温度下此反应的平衡常数:K=1.44 |