题目内容
17.下列说法或表示方法正确的是( )| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 相同条件下,1mol H2O(l)完全分解吸收的热量与H2、O2化合生成1mol H2O(l)放出的热量值不相等 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=+285.8kJ/mol |
分析 A.产物相同,反应物中S的状态不同,气态比固体能量高;
B.互为逆反应时,焓变的数值相同;
C.生成1molH2O(l)放出热量为57.3kJ,浓硫酸稀释放热;
D.在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,可知1molH2完全燃烧生成液态水,放出285.8 kJ热量.
解答 解:A.产物相同,反应物中S的状态不同,气态比固体能量高,若将等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,故A错误;
B.互为逆反应时,焓变的数值相同,则相同条件下,1mol H2O(l)完全分解吸收的热量与H2、O2化合生成1mol H2O(l)放出的热量值相等,故B错误;
C.生成1molH2O(l)放出热量为57.3kJ,浓硫酸稀释放热,则含0.5 mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ,故C正确;
D.在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,可知1molH2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、中和热、燃烧热为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
7.下列各图示与对应的描述相符合的是( )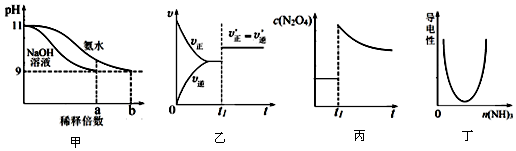

| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
12.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒的运动是有规律的,胶体中分散质微粒的运动是布朗运动 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光路 |
2.下列说法不正确的是( )
| A. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
6.有一真空瓶充入空气后质量为m1,在相同状况下,若改为充入某气体A时,总质量为m2,且m2>m1,则气体A可能是( )
| A. | H2 | B. | N2 | C. | O2 | D. | CO |
7.X、Y、Z三种元素均位于第三周期,其原子序数逐渐增大,X是本周期原子半径最大的元素,Y的最高价氧化物的水化物与X、Z的最高价氧化物的水化物都能反应,Z的单质是一种黄绿色气体.下列说法不正确的是
( )
( )
| A. | X是第IA元素,Y的最高正价是+3价 | |
| B. | Z是周期表中非金属性最强的元素 | |
| C. | 化合物XZ中含有离子键 | |
| D. | Y的单质与X、Z的最高价氧化物的水化物也都能发生反应 |
 .
.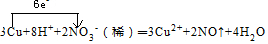 .
.
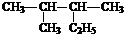 2,3-二甲基戊烷
2,3-二甲基戊烷