题目内容
18. 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗NaOH溶液的体积肯定小于20.00mL | |
| D. | pH>7时,消耗NaOH溶液的体积肯定大于20.00mL |
分析 A.反应后的溶液一定满足电荷守恒,根据电荷守恒分析;
B.pH=5时,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
C.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL,若为碱性,则加入的氢氧化钠溶液体积等于或是大于20.00mL.
解答 解:A.在反应过程中,一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.pH=5的溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),则溶液中离子浓度的大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL,故C正确;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性,若使溶液呈中性,则消耗NaOH溶液的体积小于20.00mL,pH>7时,消耗NaOH溶液的体积大于或是等于20.00mL,故D错误;
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.有一真空瓶充入空气后质量为m1,在相同状况下,若改为充入某气体A时,总质量为m2,且m2>m1,则气体A可能是( )
| A. | H2 | B. | N2 | C. | O2 | D. | CO |
13.短周期主族元素A、B,C、D的原子序数依次增大.A是周期表中原子半径最小的元素,B是周期期表中能形成化合物最多的元素,C2-和D3+离子的电子层结构相同.下列说法正确的是( )
| A. | 氢化物的稳定:B>C | |
| B. | 简单离子的半径:D>C | |
| C. | 最高氧化物对应的水化物的酸性:B>D | |
| D. | BC2、D2C3中化学键类型相冋 |
10.在含有Fe3+和Cu2+的溶液里,加入一定量铁粉,反应完成后过滤,滤渣全部是Cu,则关于滤液成分的说法,正确的是( )
| A. | 肯定含有Fe3+和Fe2+,肯定没有Cu2+ | |
| B. | 肯定含有Fe3+,肯定没有Cu2+,可能含Fe2+ | |
| C. | 肯定含有Cu2+,肯定没有Fe3+,可能含有Fe2+ | |
| D. | 肯定含有Fe2+,肯定没有Fe3+,可能含有 Cu2+ |
7.X、Y、Z三种元素均位于第三周期,其原子序数逐渐增大,X是本周期原子半径最大的元素,Y的最高价氧化物的水化物与X、Z的最高价氧化物的水化物都能反应,Z的单质是一种黄绿色气体.下列说法不正确的是
( )
( )
| A. | X是第IA元素,Y的最高正价是+3价 | |
| B. | Z是周期表中非金属性最强的元素 | |
| C. | 化合物XZ中含有离子键 | |
| D. | Y的单质与X、Z的最高价氧化物的水化物也都能发生反应 |
8.化学与人类生产、生活密切相关.下列说法正确的是( )
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 减少SO2的排放,可以从根本上消除雾霾 | |
| C. | 用电镀厂的废水直接灌溉农田,可提高水的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
 .
.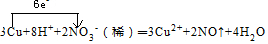 .
.