题目内容
11.用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1盐酸和HX溶液,溶液的PH随加入NaOH溶液体积变化如图所示.下列说法正确的是( )
| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
分析 A.根据未滴定时0.1mol•L-1HCl和HX溶液的pH进行判断;
B.N点为NaX溶液,NaX水解溶液呈碱性;
C.PM点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度;
D.Cl-在溶液中不水解,物质的量不变.
解答 解:A.未滴定时,0.1mol•L-1HCl溶液pH为1,HCl中氢氧根离子的浓度为10-13mol/L,由图可知0.1mol/L HX溶液的pH=5,则HX弱酸,HX溶液中氢氧根离子的浓度为10-9mol/L,HA溶液中c(OH-)是该盐酸中c(OH-)的104倍,故A正确;
B.N点溶液中,NaOH与HX恰好完全反应生成NaX,则N点为NaX溶液,NaX水解溶液呈碱性,故B错误;
C.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,所以M点c(HX)>c(X-),故C错误;
D.Cl-在溶液中不水解,物质的量不变,则P点c(Cl-)=$\frac{0.02L×0.1mol/L}{0.02L+0.01L}$=$\frac{0.1}{3}$mol•L-1,故D错误;
故选A.
点评 本题考查原理了水解、弱电解质电离、离子浓度大小判断,关键是根据M点判断相同浓度下X-的水解程度大于HX的电离程度,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
2.关于晶体的下列说法正确的是( )
| A. | 任何晶体中,若含有阳离子就一定有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 分子晶体中只含有范德华力 |
16.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理也没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
3.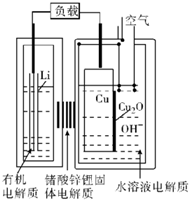 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,Cu作电池的负极 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
20.图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )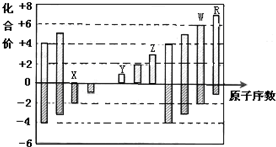

| A. | X的氢化物形成的晶体中存在的最强作用力是分子间作用力 | |
| B. | R的气态氢化物溶于水,离子键断裂 | |
| C. | W的气态氢化物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
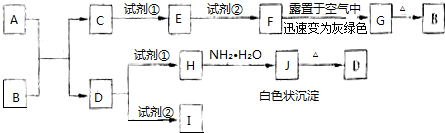
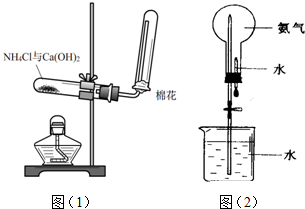

 ;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.
;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.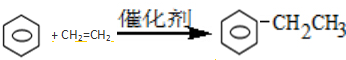 .
.