��Ŀ����
1��������̼���������ϳɼ״��������ķ�ӦΪ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����1����֪��
| ��ѧ�� | H-H | C-O | C=O | H-O | C-H |
| ���ܣ�KJ•mol-1�� | 436 | 326 | 803 | 464 | 414 |
��2��һ�������£���n��CO2����n��H2��=1��1�Ļ����������º����ܱ������У�������ʵ����˵���÷�Ӧ�Ѵﵽƽ�����BCEF����ѡ����ĸ��
A�������������ܶȱ��ֲ��� B��CO2������������ֲ���
C��H2O��g����CO2��g������������֮��Ϊ1��1 D���÷�Ӧ��ƽ�ⳣ�����ֲ���
E����������ƽ����Է����������� F��������ѹǿ���ֲ���
��3��һ�������£���2L�����ܱ������г���1.2molCO2��3.6molH2���ڲ�ͬ���������µķ�Ӧ��Ӧ���뷴Ӧ����ͬʱ����CO2ת�������¶ȱ仯�����������ʾ���ݱ������ݻ���ͼ1��
| ��ͬʱ����CO2ת���� | T1 | T2 | T3 | T4 | T5 |
| ��Ӧ�� | 65% | 77% | 80% | 80% | 66.67% |
| ��Ӧ�� | 56% | 67% | 76% | 80% | 66.67% |
| ��Ӧ�� | 48% | 62% | 72% | 80% | 66.67% |
�ٴ���Ч����ѵķ�Ӧ�Ƿ�Ӧ�����Ӧ������Ӧ������Ӧ��
��T3��b��v��������v���棩�����������������=����
��T4��a��ת���ʱ�T5��c���ԭ���Ǹ÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���
�����¶�ΪT5ʱ���÷�Ӧ��ƽ�ⳣ��K=$\frac{100}{27}$��
�����¶�ΪT5ʱ��CH3OH��Ũ����ʱ��仯��������ͼ2��ʾ��
��ʱ�䵽��t1ʱ�������ɵļ״���ˮͬʱ��ȥ����ά�ָ��¶ȣ���t2ʱ�ﵽƽ�⣮
����ͼ2 �л���t1ʱ�̺�CH3OH��Ũ�ȱ仯���������ߣ�

���� ��1����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
��2�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��3������ͬ�¶��£���ͬʱ����CO2ת����Խ��˵������Ч��Խ�ã�
��T4ʱ����ƽ��״̬������ӦΪ���ȷ�Ӧ���¶�Խ��ת����ԽС��T3ƽ��ʱת����Ӧ����T4��a��b��ת������ȣ���b��������Ӧ���У�
�۸÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���
��һ�������£���2L�����ܱ������г���1.2molCO2��3.6molH2�����¶�ΪT5ʱ��ƽ��ʱC�������̼ת����Ϊ66.67%����ת���Ķ�����̼Ϊ1.2mol��66.67%=0.8mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����0.6 1.8 0 0
�仯Ũ�ȣ�mol/L����0.4 1.2 0.4 0.4
ƽ��Ũ�ȣ�mol/L����0.2 0.6 0.4 0.4
����ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$���㣻
�ݵ�ʱ�䵽��t1ʱ�������ɵļ״���ˮͬʱ��ȥ����ά�ָ��¶ȣ�˲��״���Ũ��Ϊ��ƽ�������ƶ�������״���Ũ������ƽ��״̬���䣬��ЧΪ��ʼ����0.2mol/LCO2��0.6mol/LH2�����ƽ�⣬��Ϣ���ƽ�ⳣ������ƽ��Ũ�ȣ��ݴ���ͼ��
��� �⣺��1����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ��ʡ�H=2��803kJ/mol+3��436kJ/mol-3��414kJ/mol-326kJ/mol-3��464kJ/mol=-46kJ/mol���ʴ�Ϊ��-46��
��2��A������������������䣬���º����£������������ܶ�ʼ�ձ��ֲ��䣬��A����
B��ƽ��ʱ����ֺ������䣬CO2������������ֲ���˵������ƽ�⣬��B��ȷ��
C��H2O��g����CO2��g������������֮��Ϊ1��1��˵��������̼����������������������ȣ���Ӧ����ƽ�⣬��C��ȷ��
D���¶Ȳ��䣬ƽ�ⳣ�����䣬�÷�Ӧ��ƽ�ⳣ�����ֲ��䲻��˵������ƽ�⣬��D����
E������������������䣬�淴Ӧ���л���������ʵ�����С��ƽ����Է�����������ƽ����Է�����������˵������ƽ�⣬��E��ȷ��
F���淴Ӧ���л���������ʵ�����С�����º�����ѹǿ��С��������ѹǿ���ֲ���˵������ƽ�⣬��F��ȷ��
��ѡ��BCEF��
��3������ͬ�¶��£���ͬʱ���ڷ�Ӧ����CO2ת����Խ��˵����Ӧ�����Ч��Խ�ã��ʴ�Ϊ����Ӧ��
��T4ʱ����ƽ��״̬������ӦΪ���ȷ�Ӧ���¶�Խ��ת����ԽС��T3ƽ��ʱת����Ӧ����T4��a��b��ת������ȣ���b��������Ӧ���У���b��v��������v���棩���ʴ�Ϊ������
�۸�7��ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���������̼ת���ʽ��ͣ�
�ʴ�Ϊ���÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���
��һ�������£���2L�����ܱ������г���1.2molCO2��3.6molH2�����¶�ΪT5ʱ��ƽ��ʱC�������̼ת����Ϊ66.67%����ת���Ķ�����̼Ϊ1.2mol��66.67%=0.8mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����0.6 1.8 0 0
�仯Ũ�ȣ�mol/L����0.4 1.2 0.4 0.4
ƽ��Ũ�ȣ�mol/L����0.2 0.6 0.4 0.4
��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0.4��0.4}{0.2��0��{6}^{3}}$=$\frac{100}{27}$��
�ʴ�Ϊ��$\frac{100}{27}$��
�ݵ�ʱ�䵽��t1ʱ�������ɵļ״���ˮͬʱ��ȥ����ά�ָ��¶ȣ�˲��״���Ũ��Ϊ��ƽ�������ƶ�������״���Ũ������ƽ��״̬���䣬��ЧΪ��ʼ����0.2mol/LCO2��0.6mol/LH2�����ƽ�⣬
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L����0.2 0.6 0 0
�仯Ũ�ȣ�mol/L����x 3x x x
ƽ��Ũ�ȣ�mol/L����0.2-x 0.6-3x x x
$\frac{x��x}{��0.2-x������0.6-3x��^{3}}$=$\frac{100}{27}$�����x=0.1����ƽ��ʱ�״�Ũ��Ϊ0.1mol/L��t1ʱ�̺�CH3OH��Ũ�ȱ仯����������Ϊ��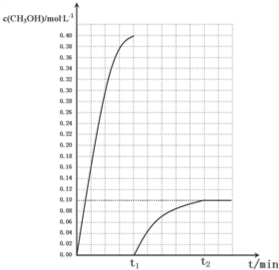 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ��״̬�жϡ���ѧƽ��ͼ��Ӧ�ȼ���ȣ���ͼΪ�״��㣬ѧ�������Զ���ƽ��ʱ�״���Ũ�ȣ��Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д� ��100mL0.1mol•L-1��立�[NH4Al��SO4��2•12H2O]��ˮ��Һ�У���ε���0.1mol•L-1��Ba��OH��2��Һ�����ó�����������Ba��OH��2��Һ�����������ͼ��ʾ[��֪Ba��AlO2��2��������]������˵����ȷ���ǣ�������
��100mL0.1mol•L-1��立�[NH4Al��SO4��2•12H2O]��ˮ��Һ�У���ε���0.1mol•L-1��Ba��OH��2��Һ�����ó�����������Ba��OH��2��Һ�����������ͼ��ʾ[��֪Ba��AlO2��2��������]������˵����ȷ���ǣ�������| A�� | a����Һ�д������ڵ�������NH4+��SO42- | |
| B�� | b����Һ��c��NH3•H2O��ԼΪ0.1mol•L-1 | |
| C�� | a��b�����У���Ӧ��ֻ��SO42- | |
| D�� | b��c�����У���Ӧ����Al��OH��3��NH4+ |
| A�� | ԭ������������ѧ���ʻ��ã�����Ϊͬ�������� | |
| B�� | �������Ͻ�ı�Ĥ���ϻ�ѧ���ʻ��� | |
| C�� | ԭ�����������ķ��նԶ�������Ĥ��Ʒû��Ӱ�� | |
| D�� | ��������Ĥ��Ʒ���ʺ��������������� |

��1�������Ҳ������仯ʾ��ͼ1����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽNO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ•mol-1��
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ3A��s��+4B��g��?4C��g����H��0
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
�����ж�K1��K2����д����������=����������
�����и�����˵���÷�Ӧ�Ѵﵽƽ��״̬����bd ������ĸ����
a��������B��C��Ũ��֮��Ϊ1��1
b��v��B����=v��C����
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ���
��3���Է�ӦN2O4��g��?2NO2��g����H��0�����¶�
�ֱ�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ2��ʾ������˵����ȷ����cd��
a��A��C����ķ�Ӧ���ʣ�A��C ���� b��A��C����Ļ�ѧƽ�ⳣ����A��C
c��A��C����N2O4��ת���ʣ�A��C d����״̬B��״̬A�������ü��ȵķ���
��4��һ���¶��£���l L�ܱ������г���1molN2��3molH2��������Ӧ���������ݻ��㶨��10min�ﵽƽ��ʱ������������ʵ���Ϊԭ����$\frac{7}{8}$����N2��ת����a��N2��=25%����NH3��ʾ�ù��̵ķ�Ӧ����v��NH3��=0.05mol/L•min��
| A�� | 2H2S+SO2�T3S��+2H2O | B�� | Zn+CuSO4�TCu+ZnSO4 | ||
| C�� | KClO3+6HCl�TKCl+3Cl2��+H2O | D�� | 2FeCl2+Cl2�T2FeCl3 |
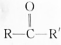 �ṹ����B�����������İ���Һ�������ɰ�ɫ��������C����֮��Ӧ�����Ʋ�A��B��C�Ĺ���ʽ��
�ṹ����B�����������İ���Һ�������ɰ�ɫ��������C����֮��Ӧ�����Ʋ�A��B��C�Ĺ���ʽ��