题目内容
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
方法一:
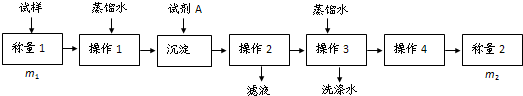
方法二:
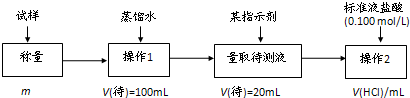
方法三:
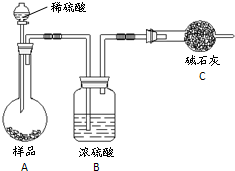
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重.操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl),填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示).
方法一:

方法二:

方法三:

方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是
(3)在方法二中计算该样品中NaHCO3的质量分数为
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是
(6)方法四的实验原理是:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:方法一:(图甲)固态样品加试剂A使碳酸氢跟生成沉淀,再经过过滤、洗涤、干燥称量沉淀的质量,从而根据碳守恒计算碳酸氢钠的质量,进而计算质量分数;
方法二:(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
方法三:(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
(1)根据以上分析:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,二者选其一即可;操作1、2、3、4的名称依次是溶解、过滤、洗涤、干燥;
(2)根据方法二的原理分析所需仪器;根据滴定终点时溶液酸碱性选择指示剂;
(3)由所用盐酸的体积可计算出20mL的待测液中碳酸氢钠的物质的量,进而计算质量分数;
(4)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量;
(5)根据装置分析,偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;偏低的原因是装置中会有残留的二氧化碳未被吸收;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数.
方法二:(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
方法三:(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
(1)根据以上分析:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,二者选其一即可;操作1、2、3、4的名称依次是溶解、过滤、洗涤、干燥;
(2)根据方法二的原理分析所需仪器;根据滴定终点时溶液酸碱性选择指示剂;
(3)由所用盐酸的体积可计算出20mL的待测液中碳酸氢钠的物质的量,进而计算质量分数;
(4)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量;
(5)根据装置分析,偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;偏低的原因是装置中会有残留的二氧化碳未被吸收;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数.
解答:
解:方法一:(图甲)固态样品加试剂A使碳酸氢跟生成沉淀,再经过过滤、洗涤、干燥称量沉淀的质量,从而根据碳守恒计算碳酸氢钠的质量,进而计算质量分数;
方法二:(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
方法三:(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
(1)方法一:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,所以试剂A为Ca(OH)2或 Ba(OH)2;与与HCO3-反应产生沉淀后应进行的操作为过滤、洗涤、干燥,故答案为:Ca(OH)2 或Ba(OH)2;过滤;干燥;
(2)方法二中固态样品加水溶解成100ml溶液,所以还需100mL的容量瓶;用标准盐酸进行滴定到终点时溶液还溶解了少量的二氧化碳,故成酸性,而酚酞的变色范围是8~10,未滴定完已变色,不可用,应使用甲基橙作指示剂,溶液由黄色变为橙色;故答案为:100mL容量瓶; 甲基橙;
(3)由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100ml,取20ml进行滴定,所以原液是待测液的5倍,所以样品中NaHCO3的质量为V(HCl)×10-3×0.100×5×84=0.042V(HCl)g,质量分数为
×100%,故答案为:
×100%;
(4)根据以上分析:方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量,故答案为:碱石灰在实验前后的质量;
(5)因为碱石灰直接与空气接触,所以偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;因为装置中还会有残留的二氧化碳,所以偏低的原因是装置中会有残留的二氧化碳未被吸收,故答案为:碱石灰可能还会吸收空气中的水气和CO2气体;圆底烧瓶内会留存部分CO2气体;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑.
方法二:(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
方法三:(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
(1)方法一:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,所以试剂A为Ca(OH)2或 Ba(OH)2;与与HCO3-反应产生沉淀后应进行的操作为过滤、洗涤、干燥,故答案为:Ca(OH)2 或Ba(OH)2;过滤;干燥;
(2)方法二中固态样品加水溶解成100ml溶液,所以还需100mL的容量瓶;用标准盐酸进行滴定到终点时溶液还溶解了少量的二氧化碳,故成酸性,而酚酞的变色范围是8~10,未滴定完已变色,不可用,应使用甲基橙作指示剂,溶液由黄色变为橙色;故答案为:100mL容量瓶; 甲基橙;
(3)由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100ml,取20ml进行滴定,所以原液是待测液的5倍,所以样品中NaHCO3的质量为V(HCl)×10-3×0.100×5×84=0.042V(HCl)g,质量分数为
| 0.042V(HCl) |
| m |
| 0.042V(HCl) |
| m |
(4)根据以上分析:方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量,故答案为:碱石灰在实验前后的质量;
(5)因为碱石灰直接与空气接触,所以偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;因为装置中还会有残留的二氧化碳,所以偏低的原因是装置中会有残留的二氧化碳未被吸收,故答案为:碱石灰可能还会吸收空气中的水气和CO2气体;圆底烧瓶内会留存部分CO2气体;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3
| ||
| ||
点评:本题主要考查对碳酸氢钠的质量分数的不同测定方法的分析计算,注意分析各种方法的原理,进而解答,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、元素原子半径从大到小的顺序是X、Y、Z |
| C、WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D、W、Y、Z元素对应的氢化物稳定性最强的是H2Y |
下列物质不能通过化合反应制得的是( )
| A、Fe(OH)2 |
| B、Fe(OH)3 |
| C、CaSiO3 |
| D、Fe(NO3)3 |






