题目内容
17.下列物质的俗称与化学式对应一致的是( )| A. | 纯碱NaOH | B. | 硫黄SO3 | C. | 铁红Fe2O3 | D. | 苏打NaHCO3 |
分析 A、纯碱是碳酸钠的俗称;
B、硫磺是单质硫的俗称;
C、铁红是Fe2O3的俗称;
D、苏打是碳酸钠的俗称.
解答 解:A、纯碱是碳酸钠的俗称,NaOH俗称烧碱,故A错误;
B、硫磺是单质硫的俗称,故B错误;
C、Fe2O3为红棕色,俗称铁红,故C正确;
D、苏打是碳酸钠的俗称,碳酸氢钠俗称小苏打,故D错误.
故选C.
点评 本题考查了常见物质的俗称,难度不大,属于识记型知识的考查,加强基础的掌握.

练习册系列答案
相关题目
8.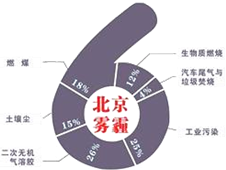 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
5.根据化合价判断下列加点元素只能表现氧化性的是( )
| A. | H$\underset{\stackrel{\;}{C}}{•}$$\underset{\stackrel{\;}{l}}{•}$ | B. | $\underset{\stackrel{\;}{F}}{•}$$\underset{\stackrel{\;}{e}}{•}$Cl2 | C. | K$\underset{\stackrel{\;}{M}}{•}$$\underset{\stackrel{\;}{n}}{•}$O4 | D. | Na2$\underset{\stackrel{\;}{S}}{•}$O3 |
2.雾霾天气影响着我们的身体健康.下列有关空气污染的说法中,不正确的是( )
| A. | 酸雨的pH<5.6 | |
| B. | SO2、NO2都能引起酸雨 | |
| C. | 雾霾一定是由汽车尾气引起的 | |
| D. | 空气中的SO2主要来自煤、石油的燃烧 |
9.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子. | |
| B. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| C. | 溶于水后电离出氢离子的化合物都是酸 | |
| D. | 二氧化碳的水溶液能导电,故二氧化碳属于电解质 |
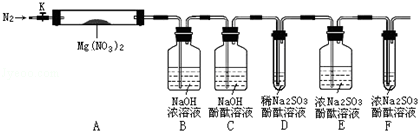
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰. 运用元素周期律研究元素及其化合物的性质具有重要意义.
运用元素周期律研究元素及其化合物的性质具有重要意义.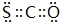 .
.