题目内容
由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2-中,两个中心离子铂的化合价是( )
| A、都是+8 | B、都是+6 |
| C、都是+4 | D、都是+2 |
考点:根据化学式判断化合价,常见元素的化合价
专题:原子组成与结构专题
分析:[Pt(NH3)6]2+中氨气分子的总化合价为0,则其中心离子Pt的化合价为+2价;[PtCl4]2-离子中氯离子的化合价为-1,设铂离子的化合价为x,x+(-1)×6=-1,解得x=+2,据此进行判断.
解答:
解:由配位键形成的离子[Pt(NH3)6]2+中,氨气的化合价为0,则[Pt(NH3)6]2+离子中铂离子的化合价为+2价;
[PtCl4]2-离子中氯离子的化合价为-1,设铂离子的化合价为x,则:x+(-1)×6=-1,解得:x=+2,
根据以上分析可知,两个中心离子铂的化合价都是+2价,
故选D.
[PtCl4]2-离子中氯离子的化合价为-1,设铂离子的化合价为x,则:x+(-1)×6=-1,解得:x=+2,
根据以上分析可知,两个中心离子铂的化合价都是+2价,
故选D.
点评:本题考查了离子中元素化合价的判断,题目难度不大,注意掌握常见元素的化合价,明确离子中各元素的化合价与离子总化合价之间的关系,试题培养了学生的分析、理解能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的是( )
A、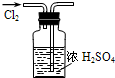 干燥Cl2 |
B、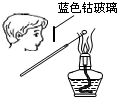 检验K2CO3中的K+ |
C、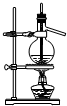 石油的蒸馏 |
D、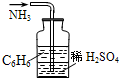 吸收NH3 |
“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质.A165Cu23Fel2是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能.有关这种拟晶的说法错误的是( )
| A、A165Cu23Fel2的硬度比金属A1、Cu、Fe都大 |
| B、A165Cu23Fel2中三种金属的化合价均可视作零 |
| C、A165Cu23Fel2不可用作长期浸泡在海水中的材料 |
| D、1mol A165Cu23Fel2溶于过量的硝酸时共失去265mol电子 |
下列离子方程式中,正确的是( )
A、向
| ||||||
| B、向氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好不再产生沉淀Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||||
| C、氯气通入水中Cl2+H2O=2H++ClO-+Cl- | ||||||
| D、向氢氧化钾溶液中滴加少量氢碘酸OH-+HI=I-+H2O |
下列关于能量的变化及反应热的说法中正确的是( )
| A、任何化学反应都有反应热 |
| B、有些化学键断裂时吸收能量,有些化学键断裂时放出能量 |
| C、新化学键的形成不一定放出能量 |
| D、有热量变化的反应一定有化学键的断裂与形成 |
(双项)小张用白纸和无色溶液给表弟写了一封“无字”信,表弟接到信拆开一看觉得很愕然,但沉思一下便明白小张的意思.经过用另一溶液简单处理后,表弟看到了一封有颜色的信,并很快写了回信.小张和表弟所用的溶液分别可能是( )
| A、前者是紫色石蕊试液,后者是稀盐酸 |
| B、前者是NaOH稀溶液,后者是酚酞 |
| C、前者是浓硫酸,后者是紫色石蕊试液 |
| D、前者是米汤,后者是碘酒 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、将0.2 mol?L-1 CH3COOH溶液和0.1 mol?L-1 NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | ||||
B、物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(N
| ||||
C、0.1 mol?L-1 NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HC
| ||||
D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(N
|