题目内容
固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KAlO2中的若干种.某同学为确定该固体粉末的成分,取X进行连续实验:以下说法正确的是( )
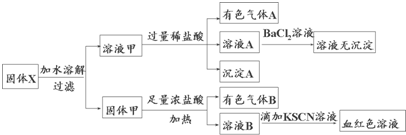

| A、溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2 |
| B、由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 |
| C、气体A和气体B一定均为纯净物 |
| D、原混合物中一定含有Fe2O3 |
考点:几组未知物的检验
专题:物质检验鉴别题
分析:固体X加水溶解过滤分为两组:易溶组:K2SiO3、K2SO3、NaNO2、KAlO2,难溶组:Fe、Fe2O3、MnO2、CuO;
溶液甲加入过量稀盐酸,放出有色气体,说明发生反应:2H++NO2-=NO2↑+NO↑+H2O,溶液甲中一定存在NaNO2;产生沉淀A,说明发生反应:2H++SiO2-=H2SiO3↓,则一定存在K2SiO3;
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生反应:2H++2NO2-+SO32-=SO42-+2NO↑+H2O,生成的硫酸根离子再与BaCl2溶液反应产生白色沉淀,无法确定是否含有KAlO2;
固体甲加入足量浓盐酸,加热后产生有色气体B,则B一定为Cl2,则混合物中含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,则原混合物中至少存在Fe、Fe2O3中的一种,
根据以上分析对各选项进行判断.
溶液甲加入过量稀盐酸,放出有色气体,说明发生反应:2H++NO2-=NO2↑+NO↑+H2O,溶液甲中一定存在NaNO2;产生沉淀A,说明发生反应:2H++SiO2-=H2SiO3↓,则一定存在K2SiO3;
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生反应:2H++2NO2-+SO32-=SO42-+2NO↑+H2O,生成的硫酸根离子再与BaCl2溶液反应产生白色沉淀,无法确定是否含有KAlO2;
固体甲加入足量浓盐酸,加热后产生有色气体B,则B一定为Cl2,则混合物中含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,则原混合物中至少存在Fe、Fe2O3中的一种,
根据以上分析对各选项进行判断.
解答:
解:固体X加水溶解过滤分为两组,易溶组:K2SiO3、K2SO3、NaNO2、KAlO2,难溶组:Fe、Fe2O3、MnO2、CuO;
溶液甲加入过量稀盐酸,放出有色气体,说明存在NaNO2(2H++NO2-=NO2↑+NO↑+H2O);产生沉淀A,说明存在K2SiO3(2H++SiO2-=H2SiO3↓);
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生2H++2NO2-+SO32-=SO42-+2NO↑+H2O,再与BaCl2溶液反应产生白色沉淀,无法确定KAlO2是否存在;
固体甲加入足量浓盐酸,加热,产生有色气体B,一定是Cl2,则一定含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,所以Fe、Fe2O3至少存在一种;
A.根据以上分析可知,溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2,故A正确;
B.根据分析可知,溶液甲中一定不存在K2SO3,否则会生成白色沉淀硫酸钡,故B错误;
C.气体A为一氧化氮和二氧化氮的混合物,气体B为氯气,属于纯净物,故C错误;
D.原混合物中Fe、Fe2O3至少存在一种,不一定含有Fe2O3,故D错误;
故选A.
溶液甲加入过量稀盐酸,放出有色气体,说明存在NaNO2(2H++NO2-=NO2↑+NO↑+H2O);产生沉淀A,说明存在K2SiO3(2H++SiO2-=H2SiO3↓);
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生2H++2NO2-+SO32-=SO42-+2NO↑+H2O,再与BaCl2溶液反应产生白色沉淀,无法确定KAlO2是否存在;
固体甲加入足量浓盐酸,加热,产生有色气体B,一定是Cl2,则一定含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,所以Fe、Fe2O3至少存在一种;
A.根据以上分析可知,溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2,故A正确;
B.根据分析可知,溶液甲中一定不存在K2SO3,否则会生成白色沉淀硫酸钡,故B错误;
C.气体A为一氧化氮和二氧化氮的混合物,气体B为氯气,属于纯净物,故C错误;
D.原混合物中Fe、Fe2O3至少存在一种,不一定含有Fe2O3,故D错误;
故选A.
点评:本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
根据反应式:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+可判断离子的还原性由强到弱的顺序是( )
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
下列离子方程式正确的是( )
| A、氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
| D、向碳酸氢钙溶液中加入少量的氢氧化钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |




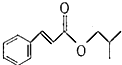 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
