题目内容
19.CO2是一种温室气体.CO2属于( )| A. | 酸 | B. | 碱 | C. | 有机物 | D. | 酸性氧化物 |
分析 A.酸是水溶液中电离出的阳离子全部是氢离子的化合物;
B.水溶液中电离出的阴离子全部是氢氧根离子的化合物;
C.一般含碳的化合物为有机物;
D.和碱反应生成盐和水的氧化物为酸性氧化物.
解答 解:CO2是一种氧化物不是酸、碱,从组成、结构和性质分析属于无机物,和碱反应生成盐和水属于酸性氧化物,故选D.
点评 本题考查了物质分类、物质组成等知识,注意概念的理解,题目较简单.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
10.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
回答下列问题:
(1)烧渣“酸溶”时发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O.
(2)第一次过滤所产生的“滤渣”是SiO2(填化学式).
(3)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(4)所得FeCO3需充分洗涤,检验是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)3.
(5)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++FeS2=3Fe2++2S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
则反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为7:3.
(6)第三次过滤所得到的“滤液”中大量存在的离子是NH4+、CO32-、SO42-(填离子符号)

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
回答下列问题:
(1)烧渣“酸溶”时发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O.
(2)第一次过滤所产生的“滤渣”是SiO2(填化学式).
(3)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(4)所得FeCO3需充分洗涤,检验是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)3.
(5)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++FeS2=3Fe2++2S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
(6)第三次过滤所得到的“滤液”中大量存在的离子是NH4+、CO32-、SO42-(填离子符号)
14.人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法正确的是( )
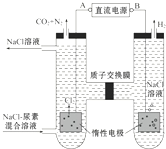

| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
4.下列物质既含有离子键又含共价键的是( )
| A. | NH3 | B. | Na2O | C. | NH4Cl | D. | H2O2 |
11.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
8.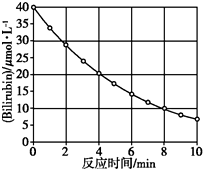 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
9.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧 | 火焰呈现黄色 | 待测液中只含Na+,不含K+ |
| B | 用铁作电极电解饱和食盐水 | 两极上均产生气体 | 阴、阳极分别生成H2和Cl2 |
| C | 向饱和氯水中加人少量石灰石 | 产生无色气体 | 酸性:HCl0>H2CO3 |
| D | 向Ca(ClO)2溶液中 通入足SO2 | 产生白色沉淀 | Ca(C1O)2具有氧化性,沉淀为CaSO4 |
| A. | A | B. | B | C. | C | D. | D |

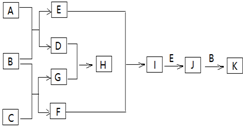 有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸.
有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸. .
.