题目内容
6.A~H等八种物质存在如下转化关系(反应条件、部分产物未标出).已知:A为正盐,B是能使品红溶液褪色的气体,E是碱性气体,G是红棕色气体.按要求回答问题: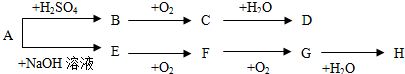
(1)写出下列物质的化学式:
BSO2,DH2SO4,ENH3,FNO.
(2)设计实验检验A溶液中的阳离子,写出实验操作、现象和结论.取少量溶液于试管中,向其中加入加入浓NaOH溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+,否则没有.
分析 G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成H,是和水反应生成硝酸和NO,所以H是硝酸;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为H2SO4,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3,据此解答.
解答 解:(1)G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成H,是和水反应生成硝酸和NO,所以H是硝酸;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为H2SO4,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3.
故答案为:SO2;H2SO4;NH3;NO;
(2)A中阳离子为NH4+,检验NH4+离子方法是:取少量该溶液于试管中,加入氢氧化钠溶液,加热,如果生成的气体能使湿润的红色石蕊试纸变蓝色,则证明有NH4+,
故答案为:取少量溶液于试管中,向其中加入加入浓NaOH溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+,否则没有.
点评 本题考查无机物推断,涉及N、S元素化合物性质及相互转化,物质的颜色是推断突破口,难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
16.下列说法正确的是( )
| A. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| B. | 所有化学变化的能量都可以通过原电池转化为电能 | |
| C. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| D. | 凡是需要加热的反应都是吸热反应 |
17.下列四组数字中,代表有机物的4种同系物的式量的( )
| A. | 16.32.48.64 | B. | 16.17.18.19 | C. | 16.30.44.58 | D. | 16.28.40.52 |
11.下列分子中各原子最外层都满足8电子稳定结构的是( )
| A. | CH4 | B. | PCl5 | C. | CCl4 | D. | SF6 |
18.下列物质能发生消去反应且产物只有一种的是( )
| A. | CH3CHICH2 CH3 | B. | CH3OH | C. | (CH3)3COH | D. | (CH3)3C-CH2C1 |
15.下列离子方程式正确的是( )
| A. | 饱和Na2CO3溶液中通过量CO2:CO32-+CO2+H2O═2HCO3- | |
| B. | 盐碱地的治理:CO32-+CaSO4═CaCO3+SO42- | |
| C. | 泡沫灭火器反应原理:2 Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
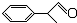 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: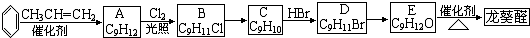
 +O2
+O2
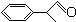 +2H2O.
+2H2O.

 盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题:
盐酸、硫酸和硝酸是常见应用于广泛的三种强酸,理解掌握酸的氧化性十分重要.请回答下列有关问题: