题目内容
10.0.5L 1mol•L-1 FeCl3溶液与1L 1mol•L-1 KCl溶液中的Cl-的物质的量浓度之比( )| A. | 3:2 | B. | 2:3 | C. | 3:1 | D. | 1:3 |
分析 每个FeCl3中含有3个Cl-,所以FeCl3溶液中c(Cl-)=3c(FeCl3),每个KCl中含有1个Cl-,所以KCl溶液中c(Cl-)=c(KCl),据此分析解答.
解答 解:每个FeCl3中含有3个Cl-,所以FeCl3溶液中c(Cl-)=3c(FeCl3)=3×0.5mol/L=1.5mol/L,每个KCl中含有1个Cl-,所以KCl溶液中c(Cl-)=c(KCl)=1mol/L,则.5L 1mol•L-1 FeCl3溶液与1L 1mol•L-1 KCl溶液中的Cl-的物质的量浓度之比=1.5mol/L:1mol/L=3:2,故选A.
点评 本题考查物质的量浓度的有关计算,明确物质浓度与离子浓度关系是解本题关键,注意:离子浓度与溶液体积大小无关,为易错点.

练习册系列答案
相关题目
20.下列各组元素的性质递变情况错误的是( )
| A. | N、O、F原子最外层电子数依次增加 | |
| B. | N、O、F原子半径依次增大 | |
| C. | Na、Mg、Al元素最高正化合价依次升高 | |
| D. | Li、Na、K的金属性依次增强 |
1.将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是( )
| A. | FeS | B. | Fe2O3 | C. | FeCl3 | D. | Fe2(SO)4 |
18.铝空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3
正极电极反应式:O2+2H2O+4e-=4OH-.
正极电极反应式:O2+2H2O+4e-=4OH-.
5.下列说法正确的是( )
| A. | 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业” | |
| B. | 用二氧化锰和浓盐酸制取氯气,每生成1 mol氯气被氧化的氯化氢为4 mol | |
| C. | 过量的铁与氯气反应时生成氯化亚铁 | |
| D. | 工业上以氯气和石灰石直接反应制造漂白粉 |
15.下列说法不正确的是( )
| A. | H2在Cl2中燃烧会产生苍白色火焰 | |
| B. | 氯水用于漂白表现了HClO的强氧化性 | |
| C. | 漂白粉是混合物,其有效成分是氯化钙 | |
| D. | 漂白粉应密封保存 |
19.下列制备和收集气体的实验装置合理的是( )
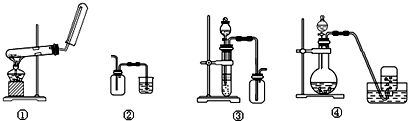

| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |
20.近代化学上常用氢化钡( BaH2)作生氢剂,反应如下:BaH2+2H2O→Ba(OH)2+2H2↑,其中氢化钡的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 即是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
