题目内容
在80℃时,将0.4mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为 ,
(2)表中b= mol/L,c d(填“<”、“=”、“>”).
(3)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 .
(4)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 .
(5)在其他条件相同时,若该反应的K值越大,表明建立平衡时 .(多选)
A.N2O4的转化率越高 B.NO2的产量越大C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
E.所耗时间越少F.容器内气体压强越大.
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.24 | 0.24 | 0.24 |
(1)该反应的化学方程式为
(2)表中b=
(3)20s时,N2O4的浓度为
(4)该反应的平衡常数表达式K=
(5)在其他条件相同时,若该反应的K值越大,表明建立平衡时
A.N2O4的转化率越高 B.NO2的产量越大C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
E.所耗时间越少F.容器内气体压强越大.
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据反应条件分析判断,结合化学平衡的三段式列式计算分析比较;
(2)结合平衡三段式列式计算分析比较判断;
(3)化学平衡的三段式列式计算N2O4的浓度,结合化学反应速率概念计算0~20s内N2O4的平均反应速率;
(4)依据化学方程式和平衡常数概念写出平衡常数表达式,依据80°C平衡状态下结合三段式列式计算平衡浓度计算平衡常数;
(5)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因,结合反应特征分析选项.
(2)结合平衡三段式列式计算分析比较判断;
(3)化学平衡的三段式列式计算N2O4的浓度,结合化学反应速率概念计算0~20s内N2O4的平均反应速率;
(4)依据化学方程式和平衡常数概念写出平衡常数表达式,依据80°C平衡状态下结合三段式列式计算平衡浓度计算平衡常数;
(5)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因,结合反应特征分析选项.
解答:
解:(1)将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,反应的化学方程式为:N2O4?2NO2,故答案为:N2O4?2NO2 ;
(2)隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;依据化学平衡三段式列式计算分析判断;进行到40S和进行到80S时;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.2 0.4
40S末(mol) 0.2 0.4
得到b=0.2mol/L;
进行进行到60s到80S时,反应达到平衡状态,c=d=e;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.24 0.48
80S末(mol) 0.16 0.48
d=c=e=
=0.08 mol/L
故答案为:0.2;=;
(3)进行到20S;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.12 0.24
20S末(mol) 0.28 0.24
20s时,N2O4的浓度=
=0.14mol/L;
0~20s内N2O4的平均反应速率=
=0.003mol/(L?s);
故答案为:0.14;0.003mol/(L?s);
(3)N2O4?2NO2,平衡常数K=
;
80°C平衡状态下,平衡浓度c(NO2)=0.24mol/L,c(N2O4)=0.08mol/L;
平衡常数K=
=
=0.72mol/L;
故答案为:
;0.72;
(5)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因;
A、平衡正向进行N2O4的转化率越高,故A正确;
B、平衡正向进行NO2的产量越大,故B正确;
C、依据上述计算分析平衡正向进行,N2O4与NO2的浓度之比越小,故C错误;
D、该反应的K值越大,说明平衡正向进行,正反应进行的程度越大,故D正确;
F、反应正向进行是气体体积增大的反应,容器内气体压强越大,故F正确;
故答案为:ABDF.
(2)隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;依据化学平衡三段式列式计算分析判断;进行到40S和进行到80S时;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.2 0.4
40S末(mol) 0.2 0.4
得到b=0.2mol/L;
进行进行到60s到80S时,反应达到平衡状态,c=d=e;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.24 0.48
80S末(mol) 0.16 0.48
d=c=e=
| 0.16mol |
| 2L |
故答案为:0.2;=;
(3)进行到20S;
N2O4?2NO2
起始量(mol) 0.4 0
变化量(mol) 0.12 0.24
20S末(mol) 0.28 0.24
20s时,N2O4的浓度=
| 0.28mol |
| 2L |
0~20s内N2O4的平均反应速率=
| ||
| 20s |
故答案为:0.14;0.003mol/(L?s);
(3)N2O4?2NO2,平衡常数K=
| c2(NO2) |
| c(N2O4) |
80°C平衡状态下,平衡浓度c(NO2)=0.24mol/L,c(N2O4)=0.08mol/L;
平衡常数K=
| c2(NO2) |
| c(N2O4) |
| 0.242 |
| 0.08 |
故答案为:
| c2(NO2) |
| c(N2O4) |
(5)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因;
A、平衡正向进行N2O4的转化率越高,故A正确;
B、平衡正向进行NO2的产量越大,故B正确;
C、依据上述计算分析平衡正向进行,N2O4与NO2的浓度之比越小,故C错误;
D、该反应的K值越大,说明平衡正向进行,正反应进行的程度越大,故D正确;
F、反应正向进行是气体体积增大的反应,容器内气体压强越大,故F正确;
故答案为:ABDF.
点评:本题考查了化学平衡的建立判断,平衡常数的计算应用,平衡移动原理的分析判断,题目难度中等.

练习册系列答案
相关题目
用U形管做电解槽,惰性电极电解Na2CO3溶液,阳极和阴极所收集气体的体积比为(气体经干燥,并在同温同压下测量)( )
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒温恒容密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和等于1 |
| D、容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、核磁共振氢普通常用于分析有机物的相对分子质量 |
| C、燃烧法是研究确定有机物成分的有效方法 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
下列各组溶液不加任何试剂就能鉴别的是( )
| A、盐酸、氢氧化钠、酚酞 |
| B、氢氧化钠、氢氧化钡、硫酸 |
| C、硫酸、碳酸钠、氢氧化钠 |
| D、硫酸铜、盐酸、硫酸 |
由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1mol CO2,推断杂质的组成不可能是( )
| A、KHCO3 |
| B、K2CO3和Na2CO3 |
| C、MgCO3和Na2CO3 |
| D、Na2CO3和NaHCO3 |
经测定由甲醛(HCHO)和乙酸乙酯(C4H8O2)组成的混合物中氧的质量分数为16%,则此混合物中氢的质量分数是( )
| A、12% | B、78% |
| C、72% | D、13% |
下列说法正确的是( )
| A、聚乙烯塑料的老化是由于发生了加成反应 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
C、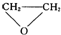 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |