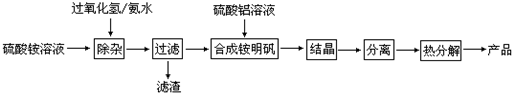
题目内容
在25℃时,100ml1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,所得溶液的pH为( )
| A、7 | B、12 | C、13 | D、无法计算 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,溶液呈碱性,计算剩余溶液中c(OH-),再根据Kw=c(H+)?c(OH-)计算溶液中c(H+),利用pH=-lgc(H+)计算;
解答:
解:100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合,溶液呈碱性,剩余溶液中n(OH-)=0.1L×(1.2mol/L-1.0mol/L)=0.02mol,溶液中c(OH-)=
=0.1mol/L,所以溶液中c(H+)=
mol/L=10-13mol/L,故溶液的pH=-lg10-13=13,
故选C.
| 0.02mol |
| 0.2L |
| 10-14 |
| 0.1 |
故选C.
点评:本题考查了酸碱溶液混合后酸碱性的分析,溶液PH的计算,掌握反应实质是关键,题目难度中等.

练习册系列答案
相关题目
某原电池的总反应离子方程为Fe+Cu2+=Fe2++Cu不能实现该反应的原电池是( )
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2 |
| B、碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| C、NH4Cl溶液显酸性的原因:NH4++H2O?NH3↑+H2O+H+ |
| D、Na2CO3的水解离子方程式:CO32-+2H2O?H2CO3+2OH- |