题目内容
2.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 标准状况下,22.4L NO与11.2L O2混合充分反应,产物的分子数为NA | |
| B. | 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA | |
| C. | l mol Cu与足量的硫充分反应,电子转移数为2NA | |
| D. | 100mL l mol•L-1KClO溶液中,阴离子的数目小于0.1NA |
分析 A.NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4;
B.乙烯与丙烯具有相同最简式CH2,1个CH2含有2个C-H键;
C.铜与硫反应生成硫化亚铜;
D.根据电荷守恒来分析.
解答 解:A.标准状况下,22.4L NO与11.2L O2混合完全反应生成二氧化氮物质的量为1mol,NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4,故反应后的产物分子个数小于NA个,故A错误;
B.14g乙烯和丙烯混合气体含有CH2物质的量为$\frac{14g}{14g/mol}$=1mol,含有C-H共价键的数目为2NA,故B正确;
C.铜与硫反应生成硫化亚铜,l mol Cu与足量的硫充分反应生成0.5mol硫化亚铜,电子转移数为NA,故C错误;
D.根据电荷守恒可知,溶液中存在:n(ClO-)+n(OH-)=n(K+)+n(H+),由于溶液中n(K+)=1mol/L×1L=1mol,故溶液中的阴离子的物质的量大于1mol,个数大于NA个,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意铜与硫粉反应生成产物为硫化亚铜,题目难度中等.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
17.卢瑟福是最伟大的实验科学家之一.他对原子结构模型研究的突出贡献在于( )
| A. | 发现了电子 | B. | 根据α提出了带核的原子结构模型 | ||
| C. | 引入的量子学说 | D. | 提出较为系统的化学原子学说 |
7.下列各图示与对应的描述相符合的是( )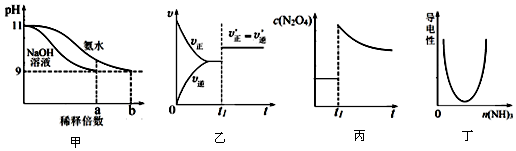

| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
14.二氧化碳的回收利用是环保领域研究热点.
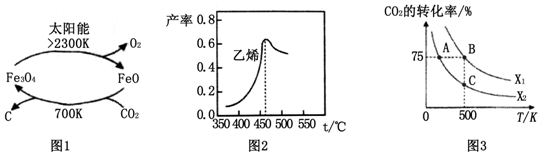
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是缩小容器体积.该温度下0~10min内H2的反应速率为0.06mol•L-1•min-1.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是AC(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图3所示.
①投料比X1>X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为KA>KB=KC;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
12.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒的运动是有规律的,胶体中分散质微粒的运动是布朗运动 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光路 |
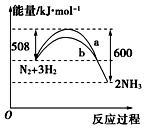 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ