题目内容
20.表中对离子方程式书写的评价正确的是( )| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2- | 正确 |
| B | Na2O2与H2O反应:Na2O2+H2O═2Na ++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O | 错误,产物应该是(OH)3 |
| D | 向FeCl3溶液中滴加足量氨水:Fe3++3OH-═Fe(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒、质量守恒;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
D.氨水为弱碱,一水合氨按不能拆开.
解答 解:A.将铜屑加入含Fe3+溶液中,反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,题中评价不合理,故A错误;
B.Na2O2与H2O反应生成氢氧化钠和氧气,正确的离子方程式为:2Na2O2+2H2O═4Na ++4OH-+O2↑,题中反应不满足电子守恒、质量守恒定律,该评价合理,故B正确;
C.NaOH溶液与氧化铝反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,题中离子方程式书写正确,该评价不合理,故C错误;
D.向FeCl3溶液中滴加足量氨水,一水合氨不能拆开,正确的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,题中离子方程式错误,该评价不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度中等,明确离子方程式的书写原则为解答关键,注意题干只要求分析“对离子方程式书写的评价”是否合理,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
10.在恒温恒容的密闭容器中,发生反应:3A(g)+B(g)?xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为a.下列有关叙述正确的是( )
| A. | 若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大 | |
| B. | 若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4 | |
| C. | 若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)+3 | |
| D. | 若体系Ⅱ起始物质的量满足3n(c)+4n(A)=12n(B),则可推断:x=4 |
8.己知四种无机化合物在水中、液氨中的溶解度(g溶质/100g溶剂)如表:
根据离子反面总是向更难溶解或更难电离的物质的方向进行这一规律
①水中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
②液氨中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
③水中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
④液氨中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
判断上述反应能发生的是( )
| 溶质 溶解度 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
①水中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
②液氨中:Ba(NO3)2+2AgCl=BaCl2+2AgNO3
③水中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
④液氨中:BaCl2+2AgNO3=Ba(NO3)2+2AgCl
判断上述反应能发生的是( )
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
15.下列根据实验操作和现象得出结论不正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 硝酸银溶液中加足量的NaCl溶液,再加KI溶液 | 先得到白色沉淀后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | 相同时间内,HA收集到的氢气多 | HA是弱酸 |
| D | 用洁净的铂丝蘸待测液进行焰色反应 | 火焰呈黄色 | 溶液中含Na+,不含K+ |
| A. | A | B. | B | C. | C | D. | D |
5.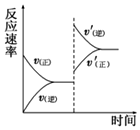 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n<p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n>p+q |
9.下列有关化学用语的表示正确的是( )
| A. | 次氯酸的电子式: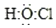 | |
| B. | 中子数为 20 的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氮原子的结构示意图: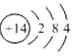 | |
| D. | Na2 S 的水解反应方程式:S2-+2H2O?H2S+2OH- |
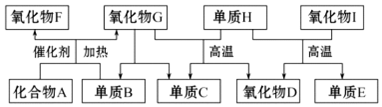
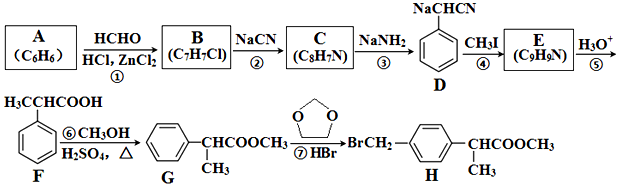
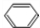 +HCHO+HCl $\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl $\stackrel{ZnCl_{2}}{→}$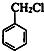 +H2O;反应⑥的化学方程式为
+H2O;反应⑥的化学方程式为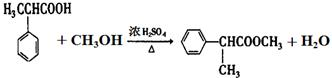 .
.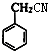 ;E的结构简式为
;E的结构简式为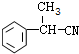 .
. .
.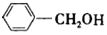 合成
合成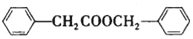 的合成
的合成 .
.