题目内容
12.写出下列有机物命名或写出结构简式:(1)
 :2-甲基戊烷;
:2-甲基戊烷;(2)2-甲基-1,3-戊二烯:CH2=C(CH3)-CH=CH-CH3;
(3)2-甲基-2-丁烯(CH3)2C=CHCH3;
(4)
 乙苯
乙苯 (5)
 4-甲基-2-戊炔.
4-甲基-2-戊炔.
分析 烷烃的命名时,要选最长的碳链为主链,从离支链近的一端对主链上的碳原子进行编号,据此进行分析;
烯烃命名时,选含官能团的最长的碳链为主链,从离双键近的一端开始编号,用双键两端编号较小的碳原子来表示出双键的位置,支链的表示方法同烷烃;
苯的同系物的命名:“苯的同系物命名是以苯作母体”,我们再结合烷烃命名的“近、简”原则,不难发现,当苯环上连有多个不同的烷基时,烷基名称的排列应从简单到复杂,环上编号从简单取代基开始,据此解答即可.
解答 解:(1) 的最长碳链为5,在2号碳上含有1个甲基,正确命名为:2-甲基戊烷,故答案为:2-甲基戊烷;
的最长碳链为5,在2号碳上含有1个甲基,正确命名为:2-甲基戊烷,故答案为:2-甲基戊烷;
(2)2-甲基-1,3-戊二烯,为二烯烃,最长碳链为5,碳碳双键分别在1、2号碳和3、4号之间,在2号碳上含有1个甲基,结构简式为:CH2=C(CH3)-CH=CH-CH3,故答案为:CH2=C(CH3)-CH=CH-CH3;
(3)2-甲基-2-丁烯,为单烯烃,最长碳链为4,碳碳双键在2、3号碳之间,在2号碳上含有1个甲基,结构简式为:(CH3)2C=CHCH3,故答案为:(CH3)2C=CHCH3;
(4) 为苯的同系物,侧链为乙基,正确命名为:乙苯,故答案为:乙苯;
为苯的同系物,侧链为乙基,正确命名为:乙苯,故答案为:乙苯;
(5) 含有碳碳三键,为炔烃,碳碳三键位于23号碳之间,在4号碳上含有1个甲基,正确命名为:4-甲基-2-戊炔,故答案为:4-甲基-2-戊炔.
含有碳碳三键,为炔烃,碳碳三键位于23号碳之间,在4号碳上含有1个甲基,正确命名为:4-甲基-2-戊炔,故答案为:4-甲基-2-戊炔.
点评 本题考查了有机物命名、有机物结构简式的书写,题目难度中等,注意掌握常见有机物的结构与性质,明确常见有机物的命名原则,能够正确书写常见有机物的结构简式.

练习册系列答案
相关题目
3.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①0min~10min以v(N2)表示的反应速率为0.014mol/(L•min).
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
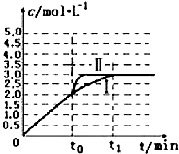
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;

②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
20.下列反应中,液体植物油不能发生的反应是( )
| A. | 加成反应 | B. | 氧化反应 | C. | 水解反应 | D. | 缩聚反应 |
1.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |

