题目内容
15.已知在相同条件下,下列几种微粒的还原性强弱顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断下列反应不能发生的是( )| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
分析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用还原性强弱顺序为Cl-<Br-<Fe2+<I-<SO2来判断反应能否发生.
解答 解:A、因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,能发生,故A不选;
B、因该反应中Br元素的化合价升高,S元素的化合价降低,则Br-为还原剂,还原性强弱为Br->SO2,与已知的还原性强弱不吻合,不能发生,故B选;
C、因该反应中Fe、Br元素的化合价升高,Cl元素的化合价降低,则FeBr2为还原剂,还原性强弱为Cl-<Br-<Fe2+,与已知的还原性强弱一致,能发生,故C不选;
D、因该反应中Fe元素的化合价降低,I元素的化合价升高,则I-为还原剂,还原性强弱为I->Fe2+,与已知的还原性强弱一致,能发生,故D不选.
故选B.
点评 本题考查利用已知的还原性强弱来判断化学反应的发生,学生应学会利用化合价来分析反应中的还原剂,并利用还原剂的还原性大于还原产物的还原性来解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列过程属于熵增加的是( )
| A. | 一定条件下水由气态变为液态 | |
| B. | 高温高压条件下使石墨转化为金刚石 | |
| C. | 有序排列的火柴散落 | |
| D. | CO点燃时生成CO2 |
20.某反应2C(g)?A(g)+2B(g)△H<0,下列判断正确的是( )
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
7.在下列各反应中,盐酸既表现出酸性又表现出氧化性的是( )
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
4.同温、同压下,决定气体体积的主要因素是( )
| A. | 气体分子的直径 | B. | 气体分子间的平均距离 | ||
| C. | 气体的分子数目 | D. | 气体分子的摩尔质量 |
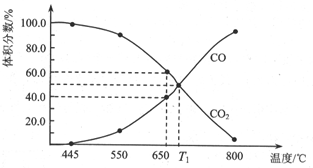 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.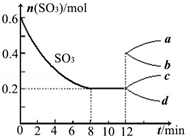 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示: ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为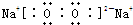 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.