题目内容
4.饱和醇(X)与足量乙酸反应生成酯(Y),相对分子质量满足Mr(Y)=Mr(X)+42,X的相对分子质量为90,且X可由烯烃与水在一定条件下反应制得.Y的结构共有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
分析 饱和醇(X)与足量乙酸反应生成酯(Y),设醇中羟基数目为n,则Mr(醇)+n×Mr(乙酸)=Mr(酯)+n×Mr(水),故Mr(酯)-Mr(醇)=n×Mr(乙酸)-n×Mr(水)=42,即60n-18n=42,解得n=1,再根据醇的相对分子质量为90,饱和一元醇的通式CnH2n+2O求出分子式,该醇可由烯烃与水在一定条件下反应制得,说明与羟基所连碳原子相邻的碳原子上有氢原子来解答.
解答 解:饱和醇(X)与足量乙酸反应生成酯(Y),设醇中羟基数目为n,则Mr(醇)+n×Mr(乙酸)=Mr(酯)+n×Mr(水),故Mr(酯)-Mr(醇)=n×Mr(乙酸)-n×Mr(水)=42,即60n-18n=42,解得n=1,
饱和一元醇的通式CnH2n+2O,醇的相对分子质量为90,所以醇的分子式为C5H12O,与羟基所连碳原子相邻的碳原子上有氢原子,则有:HOCH2CH2CH2CH2CH3、HOCH(CH3)CH2CH2CH3、HOCH(CH2CH3)2、HOCH2CH(CH3)CH2CH3、HOC(CH3)2CH2CH3、HOC(CH3)CH(CH3)2、HOCH2CH2CH(CH3)2,
故选B.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,注意确定的方法.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
14.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
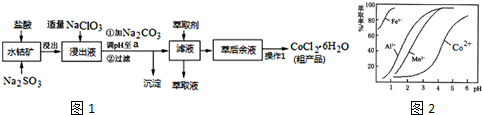
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
15.下列有关实验设计、观察或记录、结论或解释都正确的是( )
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
19.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
9.小明同学对醇、酚部分化学知识整理如下,其中正确的一组是( )
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
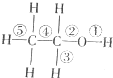 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关醇的叙述正确的是( )
| A. | 所有醇都能发生催化氧化、消去反应 | |
| B. | 低级醇(甲醇、乙醇、丙醇、乙二醇)都能与水以任意比互溶 | |
| C. | 凡烃基直接和羟基相连的化合物一定是醇 | |
| D. | 乙醇和浓硫酸按1:3体积比混合、共热就一定产生乙烯. |
15.下列说法正确的是( )
| A. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| B. | 地沟油的主要成分是高级脂肪酸甘油酯.可用于制肥皂 | |
| C. | 石油分馏的目的是为了获得乙烯、丙烯和1,3-丁二稀 | |
| D. | 乙醇,过氧化氢和臭氧可用于消毒.均体现氧化性 |
16.如图所示与对应叙述不相符的是( )
| A. |  反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. |  反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. |  反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |