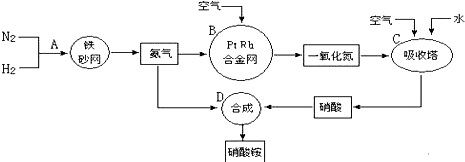
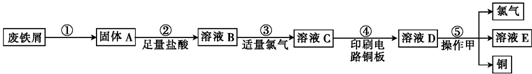
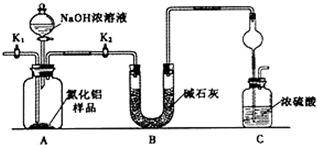
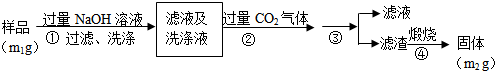
题目内容
12.由N、B、Ni等元素组成的新型材料有着广泛用途.(1)基态Ni原子的最外层电子排布式为4s2.
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O═3CO2+6H3BNH3制得.
①与上述化学方程式有关的叙述不正确的是A.(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有12个σ键.
(3)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低.如图1是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置.
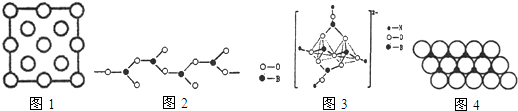
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式.图2是一种链状结构的多硼酸根,则多硼酸根离子符号为[BO2]nn-(或BO2-),图3是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为sp2、sp3.
(5)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图4),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为$\frac{2.49\sqrt{3}×1{0}^{25}}{2{a}^{2}{N}_{A}}$g(用a、NA表示)
分析 (1)Ni原子核外电子数为28,根据能量最低原理书写最外层电子排布式;
(2)①A.甲烷中C原子形成4个σ键,反应后二氧化碳分子中C原子形成2个σ键,均没有孤对电子;
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形;
C.同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于氧元素的;
D.B原子一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键;
②化合物(HB=NH)3的结构与苯的类似;
(3)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,键长越短,键能越大,熔点越高;晶体中B、N原子配位数均为4;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,利用均摊法计算每个B原子连接O原子数目,进而确定多硼酸根离子符号;
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键;
(5)根据图片知,每个氧化镍所占的面积=(2×a×10-10m)×(2×a×10-10m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)Ni原子核外电子数为28,根据核外电子排布规律可知电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,所以最外层电子排布式4s2,
故答案为:4s2;
(2)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素,故所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B原子一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确.
故选:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,
故答案为:12;
(3)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;晶体中B、N原子配位数均为4,涂“●”和画“×”分别标明B与N的相对位置为: ,
,
故答案为:B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低; ;
;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×$\frac{1}{2}$=2,代一个单位负电荷,故多硼酸根化学式为:[BO2]nn-(或BO2-),
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键,故B原子采取sp2、sp3杂化,
故答案为:[BO2]nn-(或BO2-);sp2、sp3;
(5)根据图片知,每个氧化镍所占的面积=(2×a×10-12m)×(2×a×10-12m×sin60°)=2$\sqrt{3}$a2×10-24m2,则每平方米含有的氧化镍个数=$\frac{1}{2\sqrt{3}{a}^{2}×1{0}^{-24}}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$×$\frac{1}{2\sqrt{3}{a}^{2}×1{0}^{-24}}$g=$\frac{2.49\sqrt{3}×1{0}^{25}}{2{a}^{2}{N}_{A}}$g,
故答案为:$\frac{2.49\sqrt{3}×1{0}^{25}}{2{a}^{2}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间结构、化学键、杂化轨道、晶体结构与计算等,(5)中注意计算“1NiO”的体积应包含孔隙体积,题目难度较大.

| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 不锈钢具有较强的耐腐蚀性,纯铁也有较强的耐腐蚀性 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 对石油进行分馏可以得到许多苯的同系物 |
| A. | 元素A所形成的氢化物常温下一定为气态 | |
| B. | 非金属性:A<E | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
| 目的 | 操作 | |
| A | 干燥Cl2 | 将气体通过盛有碱石灰的干燥装置 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| D | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |