题目内容
9.125gCuSO4•5H2O中含有H2O的物质的量是多少?氧原子数目是多少?(NA=6.02×1023/mol)分析 根据n=$\frac{m}{M}$计算出硫酸铜晶体的物质的量,再根据硫酸铜晶体计算出水和氧原子的物质的量以及数目.
解答 解:125gCuSO4•5H2O的物质的量为:n(CuSO4•5H2O)=$\frac{125g}{250g/mol}$=0.5mol,0.5mol CuSO4•5H2O中含有结晶水的物质的量为:0.5mol×5=2.5mol;0.5mol CuSO4•5H2O中含有氧原子的物质的量为:0.5mol×(4+5)=4.5mol,氧原子数目是4.5NA=6.02×1023/mol×4.5mol=2.709×1024个,答:含有H2O的物质的量是2.5mol,氧原子数目是2.709×1024个.
点评 本题考查了物质的量的计算,题目难度中等,注意掌握物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的转化关系,明确有关物质的量的计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列关于pH变化的判断正确的是( )
| A. | 温度升高,Na2CO3溶液pH减小 | |
| B. | 氢氧化钠溶液久置于空气中,溶液pH变大 | |
| C. | 新制氯水经光照一段时间后,溶液pH减小 | |
| D. | 温度升高,纯水pH增大 |
18.下列反应中的氨与反应4NH3+5O2═4NO+6H2O中的氨作用相同的是( )
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+H2O?NH3•H2O | D. | HCl+NH3═NH4Cl |
19.下列离子方程式书写正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 铁与氯化铁溶液反应:Fe3+Fe═2Fe2+ |
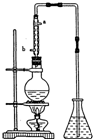 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)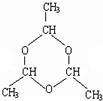 .
.