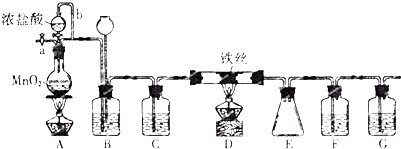
题目内容
19. 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)(1)先分离混合物得到(C2H4O)n,此分离操作是分液,用到的玻璃仪器是分液漏斗.
(2)证明是否已有部分乙醛被氧化的实验操作和现象是取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化.
(3)若将少量乙醛溶液滴入浓硫酸中,生成黑色物质和刺激性气味的气体.请写出该化学方程式:CH3CHO+H2SO4(浓)→2C↓+SO2↑+3H2O.
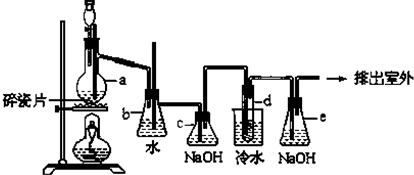
(4)提取乙醛的装置如图:烧瓶中放的是(C2H4O)n和6mol/L H2SO4的混合液,锥形瓶中放
蒸馏水.加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中. 用冷凝管的目的是使加合物冷凝回流到烧瓶内,冷凝水的进口是b.(填“a”或“b”).
(5)写出乙醛发生银镜反应的化学方程式CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+2NH3.
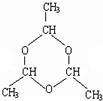
(6)若n=3,写出(C2H4O)n的结构简式(环状)
 .
.
分析 本题是探究乙醛长期放置出现分层现象的原因,对混合物分离时涉及分液及蒸馏操作,考查了操作要点,如分层是用分液,混溶时用蒸馏,蒸馏时需要用冷凝管冷却,冷却水的流向为低进高出等,另外还考查了醛的化学性质如发生银镜反应及探究加合物的结构;
(1)久置的乙醛溶液会产生分层现象,因此分离时可选择分液漏斗通过分液进行操作;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性;
(3)将少量乙醛溶液滴入热的浓硫酸中,有黑色固体物质生成,黑色物质为碳,浓硫酸具有强氧化性,可以氧化乙醛生成C,同时生成二氧化硫、水;
(4)蒸馏操作时会有部分加合物随温度的升高再挥发,如果不使用冷凝管使之液化后重新流入烧瓶内,会使得到的乙醛不纯,另外原料利用率也低;
(5)乙醛和银氨溶液在水浴加热的情况下,会生成光亮的银镜,同时自身被氧化成羧酸;
(6)乙醛分子间易形成化合物(C2H4O)n,醛基中羰基相互加成形成环状结构.
解答 解:(1)先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出,故答案为:分液;分液漏斗;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性,具体操作为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化,故答案为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化;
(3)将少量乙醛溶液滴入热的浓硫酸中,有黑色固体物质生成,黑色物质为碳,浓硫酸具有强氧化性,可以氧化乙醛生成C,同时生成二氧化硫、水,反应方程式为:CH3CHO+H2SO4(浓)→2C↓+SO2↑+3H2O,故答案为:CH3CHO+H2SO4(浓)→2C↓+SO2↑+3H2O;
(4)利用冷凝管使挥发出的加合物液化后重新流入到烧瓶内,这样既保证了乙醛的纯度,也提高了原料的利用率,冷凝时冷却水的方向与蒸汽的流向相反,应该是低时高出,故答案为:使加合物冷凝回流到烧瓶内;b;
(5)乙醛发生银镜反应的化学方程式为CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+2NH3,故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+2NH3;
(6)乙醛分子间易形成化合物(C2H4O)n,醛基中羰基相互加成形成环状结构,结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查了乙醛的化学性质,综合性较强,涉及混合物的分离和提纯、实验仪器、乙醛的特征反应等,难度一般.


查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |