题目内容
17.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,当反应中转移5mol电子时,消耗的氯气是3mol.
(2)在反应液I中加入KOH固体的目的是AC(填编号).
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)如何判断K2FeO4晶体已经洗涤干净用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净.
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42?+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
完成并配平上述反应的离子方程式.
分析 足量氯气通入氢氧化钾溶液中低温反应生成次氯酸钾、氯化钾和水,加入固体氢氧化钾除去氯化钾得到减小次氯酸钾浓溶液,加入硝酸铁浓溶液纯化洗涤干燥得到高铁酸钾;
(1)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;根据化合价升高,还原剂,得到氧化产物结合电子守恒计算转移5mol电子消耗氯气物质的量;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)检验最后一次的洗涤中无Cl-即可
(5)根据氧化还原反应电子得失守恒配平;
解答 解:(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3,KClO3是还原产物.
氯元素化合价0价变化为-1价,+1价,电子转移为e-,氯元素化合价0价变化为+5价,电子转移5mol,转移5mol电子时消耗氯气3mol,
故答案为:6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O; 3;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C.
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净.
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净.
(5)根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
故答案为:4,10,4,3,8OH-;
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
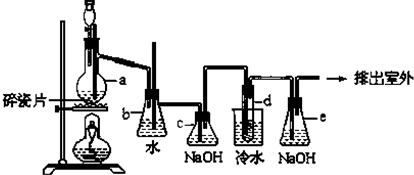
 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
| A. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 铜丝在氯气中燃烧:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$Cu2++2Cl- | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O | |
| D. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++Cu2+ |
| A. | 17 | B. | 18 | C. | 20 | D. | 37 |
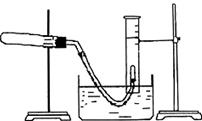 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题: