题目内容
8.O2和O3是氧元素的两种单质,根据其分子式完成下列各题:①等质量的O2和O3所含分子个数比为3:2,原子个数比为1:1,分子的物质的量之比为3:2.
②等温等压下,等体积的O2和O3所含分子个数比为1:1,原子个数比为2:3,质量比为2:3.
③设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是$\frac{22.4bc}{a{N}_{A}}$L(用含NA的式子表示).
分析 ①假设O2和O3的质量均为48g,根据n=$\frac{n}{M}$计算各自物质的量,分子数目之比等于其物质的量之比,均由O原子构成,则氧原子质量相等,含有O原子数目相等;
②假设O2和O3的体积均为22.4L,依据n=$\frac{V}{22.4L/mol}$计算各自物质的量,分子数目之比等于其物质的量之比,臭氧为3原子分子,氧气为双原子分子;依据m=nM计算各自质量;
③根据组分都为氧气,所以其质量与分子数成正比,计算cg气体的物质的量,最后根据气体体积公式求出体积,据此解答.
解答 解:①假设O2和O3的质量均为48g,
则O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,
O3的物质的量为$\frac{48g}{48g/mol}$=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1,
O2和O3分子的物质的量之比为1.5mol:1mol=3:2,
故答案为:3:2;1:1;3:2;
②假设O2和O3的体积均为22.4L,依据n=$\frac{V}{22.4L/mol}$,氧气与臭氧的物质的量都为1mol;
O2和O3均由O原子构成,臭氧为3原子分子,氧气为双原子分子,含有O原子数目分别:2NA,3NA;原子个数比为:2:3;
氧气质量m(O2)=1mol×32g/mol=32g,臭氧的质量m(O3)=1mol×48g/mol=48g,二者质量之比:32:48=2:3;
故答案为:1:1;2:3;2:3;
③根据其组分都为氧气相同,所以其质量与分子数成正比,ag氧气含有的分子数为:b个,质量与分子数的比列式为:ag:b个=cg:x个,
x=$\frac{bc}{a}$个;
cg该混合气体含有的物质的量为:n=$\frac{bc}{a{N}_{A}}$mol其体积为:V=n×Vm =$\frac{bc}{a{N}_{A}}$mol×Vm =$\frac{22.4bc}{a{N}_{A}}$L.
故答案为:$\frac{22.4bc}{a{N}_{A}}$L.
点评 本题考查了有关阿伏伽德罗常数的计算,明确相关概念及计算公式是解题关键,题目难度不大.

| A. | 油脂属于高分子化合物 | B. | 糖类都能水解 | ||
| C. | 酶是一类具有催化作用的蛋白质 | D. | 淀粉和纤维素属于同分异构体 |
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.8 g Na2O2含有的阴离子数目为0.1 NA | |
| D. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA |
| A. | 苯、己烷、四氯化碳 | B. | 乙酸乙酯、乙醇、四氯化碳 | ||
| C. | 溴苯、乙醇、四氯化碳 | D. | 溴苯、乙醇、乙酸 |
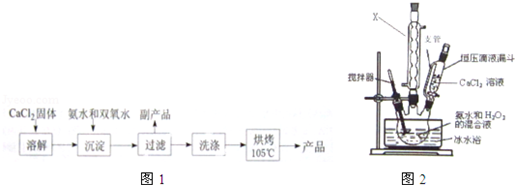
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)X仪器名称球形冷凝管.
(2)加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水B.冷水C.乙醇D.乙醚
(5)CaO2贮存时应该注意的问题是密封(或防潮、避免与易燃物接触等)(写一条即可)
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(6)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
| A. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| B. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生浑浊的快慢,来反映试剂反应速率的大小.从而探究浓度,温度等外界条件对该反应的化学反应速率的影响 | |
| C. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| D. | 为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
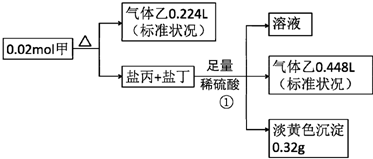

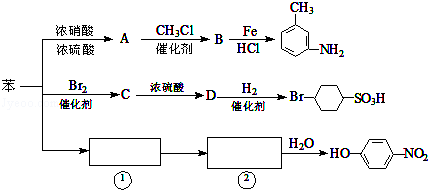
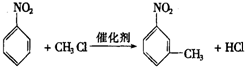 .
.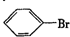 ,②
,②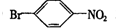 .
.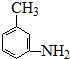 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.