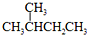题目内容
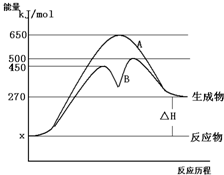 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.(1)据图判断该反应是
(2)其中B历程表明此反应采用的条件为
A. 升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
作出正确判断的理由为
(3)若△H的数值为200kJ/mol,则此反应在A反应历程中的正反应的活化能为
考点:化学平衡的影响因素,反应热和焓变
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,据此解答;
(2)由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂;
(3)正反应的活化能是反应物得到能量变化为活化分子发生有效碰撞的能量,图象中x=70KJ/mol,活化能=650-70=480KJ/mol:
(2)由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂;
(3)正反应的活化能是反应物得到能量变化为活化分子发生有效碰撞的能量,图象中x=70KJ/mol,活化能=650-70=480KJ/mol:
解答:
解:(1)由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大;
故答案为:吸;增大;
(2)由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率;
故答案为:D,降低了正逆反应活化能;
(3)若△H的数值为200kJ/mol,图象中x=70KJ/mol,则此反应在A反应历程中的正反应的活化能=650-70=480KJ/mol;
故答案为:480;70;
故答案为:吸;增大;
(2)由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率;
故答案为:D,降低了正逆反应活化能;
(3)若△H的数值为200kJ/mol,图象中x=70KJ/mol,则此反应在A反应历程中的正反应的活化能=650-70=480KJ/mol;
故答案为:480;70;
点评:本题考查了化学反应能量变化图象分析判断,反应活化能和焓变的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能,如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ?mol-1) | 414 | 489 | 565 | 155 |
| A、1940kJ?mol-1 |
| B、-1940kJ?mol-1 |
| C、-485kJ?mol-1 |
| D、485kJ?mol-1 |


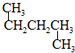 和
和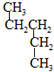
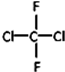 和
和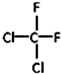 ⑦CH3CH2CH2CH3和
⑦CH3CH2CH2CH3和