题目内容
五种短周期元素的性质或原子结构信息如下表:
请根据表中信息回答下列问题:
(1)Q原子的核外电子排布式为;
(2)X气态氢化物分子的空间构型为 .X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有 .
(3)Y单质与V2O5反应的化学方程式为 .
(4)在1.01×105Pa、298K时,1.4g QR气体在1.6g R2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为 .
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
(1)Q原子的核外电子排布式为;
(2)X气态氢化物分子的空间构型为
(3)Y单质与V2O5反应的化学方程式为
(4)在1.01×105Pa、298K时,1.4g QR气体在1.6g R2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素中,Q原子核外有6种不同运动状态的电子,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素;X元素气态氢化物的水溶液呈弱碱性,则X为N元素;第三周期元素简单离子中Y离子半径最小,则Y为Al,据此解答.
解答:
解:短周期元素中,Q原子核外有6种不同运动状态的电子,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素;X元素气态氢化物的水溶液呈弱碱性,则X为N元素;第三周期元素简单离子中Y离子半径最小,则Y为Al,
(1)Q为C元素,原子核外电子排布式为:1s22s22p2,故答案为:1s22s22p2;
(2)X为N元素,气态氢化物为NH3,分子的空间构型为:三角锥形,浓硝酸与同类物质相比在化学性质上表现的特殊性有:不稳定性和强氧化性,
故答案为:三角锥形;不稳定性和强氧化性;
(3)Al单质与V2O5发生铝热反应,反应化学方程式为10Al+3V2O5
5Al2O3+6V,故答案为:10Al+3V2O5
5Al2O3+6V;
(4)发生反应:2CO+O2
2CO2,1.4gCO的物质的量=
=0.05mol,1.6g氧气的物质的量=
=0.05mol,由方程式可知,1.4gCO完全反应,放出热量为14.15kJ,故2molCO完全反应放出的热量=14.15kJ×
=566kJ,表示CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol,
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
(1)Q为C元素,原子核外电子排布式为:1s22s22p2,故答案为:1s22s22p2;
(2)X为N元素,气态氢化物为NH3,分子的空间构型为:三角锥形,浓硝酸与同类物质相比在化学性质上表现的特殊性有:不稳定性和强氧化性,
故答案为:三角锥形;不稳定性和强氧化性;
(3)Al单质与V2O5发生铝热反应,反应化学方程式为10Al+3V2O5
| ||
| ||
(4)发生反应:2CO+O2
| ||
| 1.4g |
| 28g/mol |
| 1.6g |
| 32g/mol |
| 2mol×28g/mol |
| 1.4g |
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
点评:本题考查结构性质位置关系应用,涉及核外电子排布、元素化合物性质、热化学方程式书写等,难度不大,推断元素涉及解题关键,(3)注意根据铝热反应解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
反应2SO2+O2?2SO3,5s内O2的浓度减少了0.2mol/L,则在这段时间内用SO2表示的反应速率(mol/L?s)为( )
| A、0.1 | B、0.08 |
| C、0.04 | D、0.02 |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是( )
| A、该温度为常温25℃ |
| B、由水电离出来的H+的浓度是1.0×10-12mol?L-1 |
| C、加入NaHSO4晶体抑制了水的电离 |
| D、该温度下加入等体积浓度为0.01 mol/L的NaOH溶液可使该溶液恰好呈中性 |
下列反应的离子方程式书写正确的是( )
A、向NH4HCO3溶液中少量的NaOH溶液并加热:NH4++OH-
| ||||
| B、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | ||||
| C、向NaHCO3溶液中加过量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3_ |
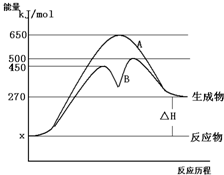 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.