题目内容
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是 (用元素符号表示).
(2)F原子的外围电子排布式为 ,F的晶体中原子的堆积方式是图中的 (填写“甲”、“乙”或“丙”).

(3)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 .
(4)任写一种与AB-离子互为等电子体的离子 .
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 .
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,已知晶体的密度为ρ g?cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用ρ、NA的计算式表示)

(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构.请分别写出氰酸和异氰酸的结构式: 、 .
(1)元素A、B、C的第一电离能由小到大的是
(2)F原子的外围电子排布式为

(3)B与C形成的四原子阴离子的立体构型为
(4)任写一种与AB-离子互为等电子体的离子
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式
(6)D和E形成的化合物的晶胞结构如图,其化学式为

(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构.请分别写出氰酸和异氰酸的结构式:
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,则其原子核外电子排布为1s22s22p2,故A为碳元素;C的基态原子2p轨道有2个未成对电子,原子序数大于A,故其核外电子排布为1s22s22p4,则C为氧元素,B的原子序数介于碳、氧之间,则B为氮元素;C与D形成的化合物中C显正化合价,则D的电负性大于C,所以D是F元素;E的M层电子数是N层电子数的4倍,处于第四周期,F原子序数大于E,也处于第四周期,其内部各能层均排满,且最外层电子数为1,则F的核外电子数=2+8+18+1=29,故F为Cu;结合原子序数可知,E原子最外层电子数只能为2,M层电子数是8,则E是Ca元素,据此解答.
解答:
解:(1)(1)同周期随原子序数增大第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于氧元素,故第一电离能C<O<N,
故答案为:C<O<N;
(2)F除最外层原子轨道处于半充满状态,其余能层均充满电子,为Cu,原子序数为29,原子核外电子排布为:1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1,Cu晶体属于面心立方最密堆积,为ABC型排列方式,故图丙符合,
故答案为:3d104s1;丙;
(3)B与C形成的四原子阴离子为NO3-,NO3-离子中N原子价层电子对数=3+
=3,且N原子不含孤电子对,所以其空间构型为平面三角形,N原子采用sp2杂化,故答案为:平面三角形;sp2;
(4)原子个数相等、价电子数相等的微粒互为等电子体,与CN-离子互为等电子体离子有C22-或O22+,故答案为:C22-或O22+;
(5)Cu(OH)2溶于氨水的离子方程式为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)该晶胞中F原子个数=8,钙原子个数=8×
+6×
=4,所以钙原子和氟原子个数之比=4:8=1:2,则其化学式为:CaF2,晶胞的质量=4×
g=
g,边长=
=
cm,
故答案为:CaF2;
;
(7)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构,可知氰酸的结构式为H-O-C≡N,异氰酸的结构式为H-N=C=O,
故答案为:H-O-C≡N;H-N=C=O.
故答案为:C<O<N;
(2)F除最外层原子轨道处于半充满状态,其余能层均充满电子,为Cu,原子序数为29,原子核外电子排布为:1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1,Cu晶体属于面心立方最密堆积,为ABC型排列方式,故图丙符合,
故答案为:3d104s1;丙;
(3)B与C形成的四原子阴离子为NO3-,NO3-离子中N原子价层电子对数=3+
| 5+1-2×3 |
| 2 |
(4)原子个数相等、价电子数相等的微粒互为等电子体,与CN-离子互为等电子体离子有C22-或O22+,故答案为:C22-或O22+;
(5)Cu(OH)2溶于氨水的离子方程式为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)该晶胞中F原子个数=8,钙原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 78 |
| NA |
| 312 |
| NA |
| 3 |
| ||||
| 3 |
| ||
故答案为:CaF2;
| 3 |
| ||
(7)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构,可知氰酸的结构式为H-O-C≡N,异氰酸的结构式为H-N=C=O,
故答案为:H-O-C≡N;H-N=C=O.
点评:本题考查了物质结构和性质,涉及电离能、等电子体、分子结构、杂化轨道、配合物、晶胞结构与计算等,为常考知识点,注意掌握中学常见配合物,晶胞结构需要学生具有一定的空间想象能力,侧重对学生综合能量的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列检验试剂选用正确的是( )
| A、用氯水、KSCN溶液检验FeCl3中是否有FeCl2溶液 |
| B、用酸性KMnO4溶液检验FeCl3中是否有FeCl2 |
| C、用NaOH溶液检验MgCl2中是否有FeCl2 |
| D、用硝酸检验某黄色固体是纯铜还是黄铜 |
反应2SO2+O2?2SO3,5s内O2的浓度减少了0.2mol/L,则在这段时间内用SO2表示的反应速率(mol/L?s)为( )
| A、0.1 | B、0.08 |
| C、0.04 | D、0.02 |
 A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.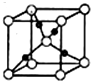 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.
向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.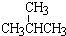 和
和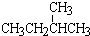 ;②正戊烷和
;②正戊烷和 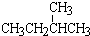 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)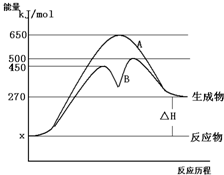 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.