题目内容
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能,如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ?mol-1) | 414 | 489 | 565 | 155 |
| A、1940kJ?mol-1 |
| B、-1940kJ?mol-1 |
| C、-485kJ?mol-1 |
| D、485kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:依据反应焓变△H=断裂化学键吸收的能量-形成化学键放出的热量计算得到;
解答:
解:CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H依据键能计算,△H=断裂化学键吸收的能量-形成化学键放出的热量=414KJ/mol×4+155KJ/mol×4-(489KJ/mol×4+565KJ/mol×4)=-1940kJ?mol-1;
故选B.
故选B.
点评:本题考查了化学反应能量变化,反应焓变利用键能的计算方法,掌握基础是关键,题目较简单.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
反应2SO2+O2?2SO3,5s内O2的浓度减少了0.2mol/L,则在这段时间内用SO2表示的反应速率(mol/L?s)为( )
| A、0.1 | B、0.08 |
| C、0.04 | D、0.02 |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是( )
| A、该温度为常温25℃ |
| B、由水电离出来的H+的浓度是1.0×10-12mol?L-1 |
| C、加入NaHSO4晶体抑制了水的电离 |
| D、该温度下加入等体积浓度为0.01 mol/L的NaOH溶液可使该溶液恰好呈中性 |
某有机物的结构简式如图所示,下列说法错误的是( )


| A、该物质能和氯化铁溶液发生显色反应 |
| B、该物质含有两种含氧官能团 |
| C、该物质可使溴的四氯化碳溶液褪色 |
| D、该物质既可以发生取代反应又可以发生加成反应 |
下列有关仪器的使用正确的是( )
| A、用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
| B、手持试管给试管内的物质加热 |
| C、用燃着的酒精灯去点燃另一盏酒精灯 |
| D、用天平称量药品时用手直接拿砝码 |
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体NaOH溶于水
⑤H2在Cl2中燃烧
⑥铝与Fe2O3高温下反应.
①液态水变成水蒸气
②酸碱中和反应
③浓H2SO4稀释
④固体NaOH溶于水
⑤H2在Cl2中燃烧
⑥铝与Fe2O3高温下反应.
| A、①③④⑤ | B、②③④ |
| C、②③④⑤ | D、②⑤⑥ |
下列反应的离子方程式书写正确的是( )
A、向NH4HCO3溶液中少量的NaOH溶液并加热:NH4++OH-
| ||||
| B、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | ||||
| C、向NaHCO3溶液中加过量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3_ |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得:c(A)为0.5mol/L,保持温度不变,将容器的容积扩大为原来的2倍,达到新平衡时测得c(A)为0.22mol/L.下列有关判断对的是( )
| A、x+y>z |
| B、化学反应速率将比原来的更快 |
| C、A、B的转化率减小 |
| D、混合气体的平均摩尔质量变小 |
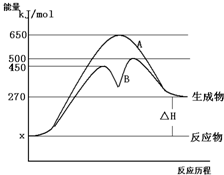 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.