题目内容
已知在1×105 Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol-1 |
| B、H2O(g)═H2(g)+O2(g)△H=+242 kJ?mol-1 |
| C、H2(g)+O2(g)═H2O(g)△H=+242 kJ?mol-1 |
| D、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ?mol-1 |
考点:热化学方程式
专题:
分析:A.根据反应放热时焓变符号为负来判断;
B.根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析;
C.根据反应放热时焓变符号为负来判断;
D.根据物质的聚集状态来判断.
B.根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析;
C.根据反应放热时焓变符号为负来判断;
D.根据物质的聚集状态来判断.
解答:
解:A.反应为放热反应,此时焓变符号为负,故A错误;
B.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,有:H2O(g)=H2(g)+
O2(g)△H=+242kJ?mol-1,故B正确;
C.反应为放热反应,此时焓变符号为负,故C错误;
D.生成的水应该为气态,而不是液态,故D错误;
故选B.
B.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,有:H2O(g)=H2(g)+
| 1 |
| 2 |
C.反应为放热反应,此时焓变符号为负,故C错误;
D.生成的水应该为气态,而不是液态,故D错误;
故选B.
点评:本题主要考查热化学方程式的书写与判断,难度不大,是高考的热点题型.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
有关如图装置的叙述不正确的是( )
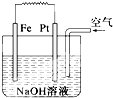

| A、这是电解NaOH溶液的装置 |
| B、该装置中Pt为正极,电极反应为O2+2H2O+4e-═4OH- |
| C、该装置中Fe为负极,电极反应为Fe-2e-═Fe2+ |
| D、这是一个原电池装置 |
滴加新制氯水后,下列各组离子可能大量存在的是( )
| A、Fe3+、Al3+、Cl-、SO42- |
| B、K+、Na+、SO32-、SO42- |
| C、Ag+、Ca2+、NH4+、NO3- |
| D、Na+、Ba2+、CO32-、SO42- |
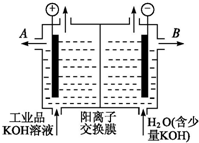 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: