题目内容
19.下列金属冶炼原理的化学反应中,属于置换反应的是( )| A. | 电解熔融的氯化钠制取钠 | B. | 用一氧化碳还原氧化铁制取铁 | ||
| C. | 加热分解氧化汞制取汞 | D. | 铁与硫酸铜溶液反应制取铜 |
分析 置换反应是单质与化合物生成单质与化合物反应,置换反应可用 A+BC→B+AC的通式进行判断,电解熔融的氯化钠制取钠、加热分解氧化汞制取汞属于分解反应,用一氧化碳还原氧化铁制取铁属于氧化还原反应,但反应物无单质,不属于置换反应,铁与硫酸铜溶液反应制取铜属于置换反应.
解答 解:A.电解熔融氯化钠生成钠和氯气,反应方程式为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,反应物只有一种且为化合物,不属于置换反应,故A错误;
B.在高温下和氧化铁反应生成铁和二氧化碳,反应方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应物无单质,不属于置换反应,故B错误;
C.加热氧化汞生成汞和氧气,反应的化学方程式为;2HgO$\frac{\underline{\;\;△\;\;}}{\;}$O2↑+2Hg,该反应符合“一变多”的特征,属于分解反应,不属于置换反应,故C错误;
D.硫酸铜与铁反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu,反应物Fe为单质、CuSO4为化合物,生成物FeSO4为化合物,Cu为单质,符合A+BC→B+AC的特征,属于置换反应,故D正确;
故选D.
点评 本题考查置换反应的判断,只要是符合A+BC→B+AC的特征的反应就是置换反应,另外掌握各选项具体的化学反应也是解题的关键,题目难度不大.

练习册系列答案
相关题目
10.下列有关说法正确的是( )
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
14.下列有机化合物中均含有杂质,除去这些杂质的方法中正确的是( )
| A. | 苯中含苯酚杂质:加入溴水,过滤 | |
| B. | 乙烷中含乙烯杂质:通入酸性高锰酸钾溶液,洗气 | |
| C. | 乙醇中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 |
4. 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )| A. | 该反应的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 反应速率:v (Ⅱ)<v (Ⅲ) | |
| C. | 平衡时CO的转化率:α(Ⅰ)<α(Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,100℃)<c(CH3OH,200℃) |
11.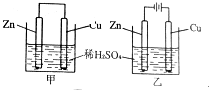 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )
 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )| A. | 甲乙装置中的铜片都作正极 | |
| B. | 甲乙装置中的溶液内的H+均在锌片上被氧化 | |
| C. | 甲乙装置中锌片上发生的反应都是还原反应 | |
| D. | 甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
8.下列实验的现象与对应的结论均正确的是( )
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
9. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度.
向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD.
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-)
B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-)
D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
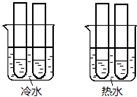
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度.
向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD.
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-)
B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-)
D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.