题目内容
15.下列有关阿伏加德罗常数(NA)的说法错误的是( )| A. | 44 g CO2所含的原子数为NA | |
| B. | 0.5 mol H2O含有的原子数目为1.5NA | |
| C. | 1 mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个O2的物质的量是0.5 mol |
分析 A.44g二氧化碳的物质的量为1mol,含有3mol原子;
B.0.5mol水分子中含有1.5mol原子;
C.1mol水分子中含有NA个水分子;
D.根据n=$\frac{N}{{N}_{A}}$计算出0.5NA个O2的物质的量.
解答 解:A.44g二氧化碳的物质的量为:$\frac{44g}{44g/mol}$=1mol,1mol二氧化碳分子中含有3mol原子,所含的原子数为3NA,故A错误;
B.0.5 mol H2O含有1.5mol原子,含有的原子数目为1.5NA,故B正确;
C.1 mol H2O中含有H2O分子的数目为NA,故C正确;
D.0.5NA个O2的物质的量是:n=$\frac{0.5{N}_{A}}{{N}_{A}}$mol=0.5mol,故D正确;
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
6.下列说法正确的是( )
| A. | 在原电池中电子由正极流向负极 | |
| B. | 原电池负极和电解池阳极均发生氧化反应 | |
| C. | 在电解池中有氢气生成的电极可能是阳极 | |
| D. | 电镀时,镀层金属做阴极 |
3.某有机物的结构简式如图,下列说法正确的是( )


| A. | 该有机物的分子式为C11H15O3 | |
| B. | 该有机物不能发生取代反应 | |
| C. | 1 mol该物质与足量的钠反应可以生成1 mol氢气 | |
| D. | 1 mol该有机物可以与1 mol碳酸钠发生反应 |
10.下列有关说法正确的是( )
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
4. 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
 在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )
在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)═CH3OH(g).图甲表示有、无催化剂时反应的能量变化,图乙表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系(图中I、II、III点均处于曲线上).下列叙述正确的是( )| A. | 该反应的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 反应速率:v (Ⅱ)<v (Ⅲ) | |
| C. | 平衡时CO的转化率:α(Ⅰ)<α(Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,100℃)<c(CH3OH,200℃) |
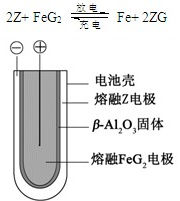 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.回答下列问题:
 +H2O
+H2O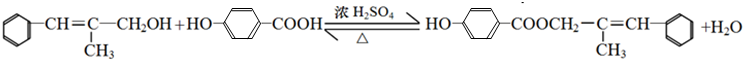
 .
.