题目内容
15.常温下,向amol•L-1某弱酸HA溶液中滴加等体积的bmol•L-1氢氧化钠溶液恰好使溶液呈中性,该温度下,HA的电离常数表达式为 ( )| A. | $\frac{b}{(a+b)×1{0}^{7}}$ | B. | $\frac{b}{(a-b)×1{0}^{7}}$ | C. | $\frac{b}{(a-b)×1{0}^{5}}$ | D. | $\frac{a-b}{a×1{0}^{7}}$ |
分析 依据电荷守恒得到氢离子浓度和氢氧根离子浓度相同,常温下为10-7mol/L,弱酸HA的平衡常数只随温度变化,所以根据反应后的溶液中弱酸HA电离常数计算即可;
解答 解:向amol•L-1某弱酸HA溶液中滴加等体积的bmol•L-1氢氧化钠溶液恰好使溶液呈中性,所以c(H+)=c(OH-)=10-7mol/L;依据溶液中电荷守恒c(Na*)+c(H+)=c(OH-)+c(A-),此时溶液中c(Na*)=c(A-),假设弱酸HA和氢氧化钠体积为1L,得到n(Na+)=bmol,n(HA)=amol,反应后溶液中弱酸HA的电离常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{b×1{0}^{-7}}{a-b}$=$\frac{b}{(a-b)×1{0}^{7}}$,故选B.
点评 本题考查了弱电解质的特点、求电离平衡常数,题目难度中等,学生只要掌能电离常数的表达式求可以迅速解题,比较容易.

练习册系列答案
相关题目
5.高温下,某反应达到平衡,平衡常数K=$\frac{[CO][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]}$,保持其他条件不变,若温度升高,c(H2)减小.对该反应的分析正确的是( )
| A. | 反应的化学方程式为:CO+H2O?CO2+H2 | |
| B. | 升高温度,v(正)、v(逆)都增大,且v(逆)增大更多 | |
| C. | 缩小容器体积,v(正)、v(逆)都增大,且v(正)增大更多 | |
| D. | 升高温度或缩小容器体积,混合气体的平均相对分子量都不会发生改变 |
6.下列说法不正确的是( )
| A. | 臭氧与空气中的氮氧化合物发生作用后会产生光化学烟雾,对人体健康、植物成长等都有很大危害 | |
| B. | 农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物哪个)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
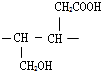
3.有机物X的分子数为C6H10O2,在稀硫酸中加热可得到Y、Z两种物质,其中Y能使溴的CCl4溶液褪色,能与NaHCO3溶液反应且分子中只含有一个甲基,则X最多有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
7.向含有5×10-3mol HIO3与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去.则在整个过程中( )
| A. | 共得到0.96g硫 | B. | 通入H2S的体积为336mL | ||
| C. | 硫元素先被还原后被氧化 | D. | 转移电子总数为3.0×10-2NA |
10.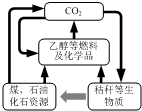 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )| A. | 大力发展煤的气化及液化技术 | B. | 加快石油等化石燃料的开采和使用 | ||
| C. | 以CO2 为原料生产可降解塑料 | D. | 将秸秆进行加工转化为乙醇燃料 |
11.对下图的实验装置和操作评价不合理的是( )


| 选项 | 装置和操作 | 评价 |
| A | 用装置①量取15.00ml的NaOH溶液 | 错误:不能用酸式滴定管,应改用碱式滴定管 |
| B | 用装置②制备Cl2 | 错误:氯气密度大于空气,收集时导管应长进短出 |
| C | 用装置③验证溴乙烷发生消去反应生成烯烃 | 正确:生成的乙烯可使高锰酸钾褪色 |
| D | 关闭活塞a,从b处加水,以检查装置④的气密性 | 正确:b处加水后,左右液面形成稳定的高度差,证明气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
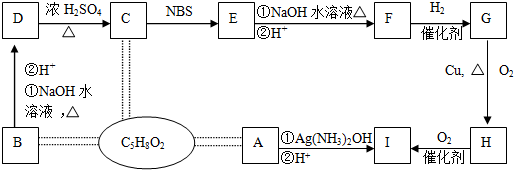
 ;
;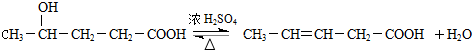 ;
;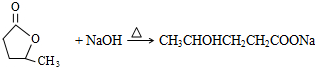 ;
;