题目内容
镁条投入5mL 0.2mol/L CuSO4溶液中,其表面立即有气泡产生,周围有红色固体出现;片刻后底部又有大量蓝色沉淀生成;待较长时间后,若镁条过量,蓝色固体消失,有白色沉淀生成,气泡继续产生,而红色质量没有明显增加.
(1)写出反应中的全部离子反应方程式:
(2)解释实验中蓝色沉淀消失和白色沉淀生成的原因: .
(1)写出反应中的全部离子反应方程式:
(2)解释实验中蓝色沉淀消失和白色沉淀生成的原因:
考点:镁的化学性质
专题:几种重要的金属及其化合物
分析:CuSO4是强酸弱碱盐,水解显酸性;铜元素在金属活动性顺序表中排在镁之后,能被镁置换出;铜离子是弱碱阳离子,在酸性较弱的环境中水解完全;当镁条过量时,Mg2+的大量存在影响到了Cu(OH)2的溶解平衡,导致Cu(OH)2的溶解,并产生Mg(OH)2沉淀;后金属镁继续与H+反应生成氢气,据此来写出离子方程式.
解答:
解:CuSO4是强酸弱碱盐,水解显酸性,故镁条先与H+反应生成氢气,离子方程式为:Mg+2H+=Mg2++H2↑;随着反应的进行,H+浓度减小,由于铜元素在金属活动性顺序表中排在镁之后,能被镁置换出,故此时会发生镁与CuSO4的置换反应,离子方程式为:Mg+Cu2+=Mg2++Cu;铜离子是弱碱阳离子,当PH>4.7时,Cu2+开始水解生成Cu(OH)2蓝色沉淀,离子方程式:Cu2++2H2O=Cu(OH)2+2H+;Cu(OH)2存在溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),当镁条过量时,Mg2+的大量存在,使Cu(OH)2的溶解平衡向右移,生成了Cu2+和Mg(OH)2白色沉淀,导致了Cu(OH)2的溶解:Mg2++Cu(OH)2=Cu2++Mg(OH)2↓;由于产生了Cu2+,水解显酸性,故镁条能继续与Cu2++水解产生的H+反应生成氢气.
(1)发生反应的离子方程式有:Mg+2H+=Mg2++H2↑;Mg+Cu2+=Mg2++Cu;Cu2++2H2O=Cu(OH)2+2H+;:Mg2++Cu(OH)2=Cu2++Mg(OH)2↓;
故答案为:Mg+2H+=Mg2++H2↑;Mg+Cu2+=Mg2++Cu;Cu2++2H2O=Cu(OH)2+2H+;Mg2++Cu(OH)2=Cu2++Mg(OH)2↓;
(2)蓝色沉淀消失和白色沉淀生成的原因是:Cu(OH)2存在溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),当镁条过量时,Mg2+的大量存在,使Cu(OH)2的溶解平衡向右移,生成了Cu2+和Mg(OH)2白色沉淀,导致了蓝色Cu(OH)2的溶解和白色Mg(OH)2沉淀的生成.
故答案为:Cu(OH)2存在溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),当镁条过量时,Mg2+的大量存在,使Cu(OH)2的溶解平衡向右移,生成了Cu2+和Mg(OH)2白色沉淀,导致了蓝色Cu(OH)2的溶解和白色Mg(OH)2沉淀的生成.
(1)发生反应的离子方程式有:Mg+2H+=Mg2++H2↑;Mg+Cu2+=Mg2++Cu;Cu2++2H2O=Cu(OH)2+2H+;:Mg2++Cu(OH)2=Cu2++Mg(OH)2↓;
故答案为:Mg+2H+=Mg2++H2↑;Mg+Cu2+=Mg2++Cu;Cu2++2H2O=Cu(OH)2+2H+;Mg2++Cu(OH)2=Cu2++Mg(OH)2↓;
(2)蓝色沉淀消失和白色沉淀生成的原因是:Cu(OH)2存在溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),当镁条过量时,Mg2+的大量存在,使Cu(OH)2的溶解平衡向右移,生成了Cu2+和Mg(OH)2白色沉淀,导致了蓝色Cu(OH)2的溶解和白色Mg(OH)2沉淀的生成.
故答案为:Cu(OH)2存在溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),当镁条过量时,Mg2+的大量存在,使Cu(OH)2的溶解平衡向右移,生成了Cu2+和Mg(OH)2白色沉淀,导致了蓝色Cu(OH)2的溶解和白色Mg(OH)2沉淀的生成.
点评:本题考查了盐类的水解、溶解平衡与金属之间的置换反应,根据现象来分析反应,难度较大.

练习册系列答案
相关题目
下列应用不涉及氧化还原反应的是( )
| A、Na2O2用作呼吸面具的供氧剂 |
| B、工业上电解熔融状态的Al2O3制备Al |
| C、工业上利用热纯碱溶液清洗油污 |
| D、用焰色反应鉴定是否有钾元素存在 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L的戊烷所含的分子数为0.5 NA |
| B、26g乙炔所含共用电子对数目为3 NA |
| C、标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |



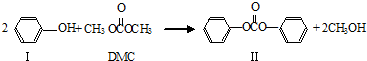
 名称为
名称为 名称为
名称为 名称为
名称为