题目内容
20.有下列各组物质A.O2和O3 B.CH3-CH2-CH2-CH3和
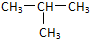 C.12C和13C
C.12C和13C D.H2O和D2O E.CO(NH2)2和NH4CNO F.
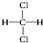 和
和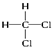
G.C60和金刚石 H.(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3
(1)C组两物质互为同位素;
(2)AG组两物质互为同素异形体;
(3)BEH组两物质互为同分异构体;
(4)DF组中两物质是同一物质.
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物;分子式相同结构不同的化合物互称同分异构体;质子数相同中子数不同的同一元素的不同原子互称同位素,同位素必须原子;同一元素形成的不同单质称同素异形体,同素异形体必须是单质;根据定义分析判断.
解答 解:A.氧气和臭氧是氧元素的不同单质,所以是同素异形体;
B.丁烷和2-甲基丙烷的分子式相同,但结构不同,所以是同分异构体;
C.12C和13C都是碳元素的不同原子,所以是同位素;
D.H2O和D2O都是氢元素和氧元素组成的,结构相同,属于同一物质;
E.NH4CNO和CO(NH2)2的分子式都为CH4N2O,二者结构不同,属于同分异构体;
F. 和
和 组成元素和结构相同,是同一物质;
组成元素和结构相同,是同一物质;
G.C60和金刚石都是由碳元素组成的不同单质,互为同素异形体;
H.(CH3)2CHCH(CH3)2和 (CH3)2CH(CH2)2CH3分子式相同,但结构不同,所以是同分异构体.
故答案为:(1)C (2)AG (3)BEH (4)DF.
点评 本题考查“四同”的概念,难度不大,掌握其定义和特征是解题的关键,注意同分异构体和同种物质的区别.

①Fe3+②Mg2+③Fe2+④NH4+.
| A. | 只有①③ | B. | 只有①④ | C. | 只有②④ | D. | 只有③④ |
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-?+H2↑ | |
| C. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A. | 反应开始到t2时,反应达到平衡状态 | |
| B. | 反应开始到t1(t1=1s),N的物质的量浓度变化了2mol/L | |
| C. | 反应开始到t2(t2=2s),用M表示反应速率为0.5mol/(L.s) | |
| D. | 反应的化学方程式为:N(g)?2M(g) |
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7个主族、7个副族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 |
以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 2.2〜2.9 | 2.8 | 22〜28 | 60〜65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
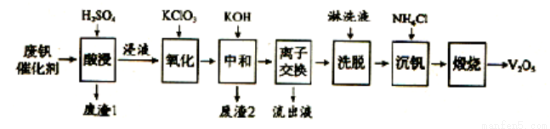
(1) “酸浸”时V2O5转化为VO2+,反应的离子方程式为 ,同时V2O4转成VO2+,“废渣1”的主要成分是 。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为 mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有 。
(4)“离子交换”和“洗脱”可简单表示为:4R0H+ V4 0124-
0124-  R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 。

 质量分数/%
质量分数/% 〜3.1
〜3.1