题目内容
3.镁、铝、铁三种金属分别与足量的盐酸反应,生成相同质量的氢气,则参加反应的三种金属( )| A. | 物质的量相等 | B. | 失去电子的物质的量相等 | ||
| C. | 质量比为24:27:26 | D. | 质量比为12:18:28 |
分析 盐酸足量,生成相同质量的氢气,则Mg、Al、Fe失去电子相同,以此来解答.
解答 解:设Mg、Al、Fe的物质的量分别为x、y、z,则
A.生成氢气相同,则金属失去电子相同,可知2x=3y=2z,金属的物质的量不同,故A错误;
B.生成氢气相同,则金属失去电子相同,故B正确;
C.金属失去电子相同,则金属的物质的量比为3:2:3,质量比为24×3:27×2:56×3,故C错误;
D.金属失去电子相同,则金属的物质的量比为3:2:3,质量比为24×3:27×2:56×3=12:9:28,故D错误;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握盐酸足量及金属的失去电子相同为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.下列说法中正确的是( )
| A. | 铁是黑色金属,所以断口是黑色的 | B. | 铁是第ⅧB族元素,也是过渡元素 | ||
| C. | 在自然界中无游离态的铁存在 | D. | 自然界里含铁的矿物质叫铁矿石 |
14.元素周期表中某区域的一些元素多用于制造催化剂及耐高温材料,它们是( )
| A. | 稀有气体元素 | |
| B. | 过渡元素 | |
| C. | 氟、氯、硫、磷元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
11.某溶液中有NH4+、Mg2+、Fe2+、Fe3+和NO3-五种离子,向该溶液的中加入过量的氢氧钠溶液,微热并搅拌,再加入过量盐酸,则溶液中大量减少的阳离子是( )
①Fe3+②Mg2+③Fe2+④NH4+.
①Fe3+②Mg2+③Fe2+④NH4+.
| A. | 只有①③ | B. | 只有①④ | C. | 只有②④ | D. | 只有③④ |
18.如图装置所示的实验中,不能达到实验目的是( )
| A. | 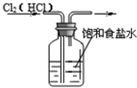 除去氯气中的氯化氢 | B. | 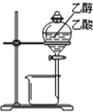 分离乙醇与乙酸 | ||
| C. | 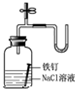 证明铁生锈空气参与反应 | D. | 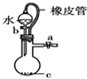 橡皮管的作用是控制水能顺利流下 |
8.下列反应的离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-?+H2↑ | |
| C. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
15.下列说法正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
12.下列说法中错误的是( )
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7个主族、7个副族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 |
 Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+
Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+