题目内容
13.常温下,水的离子积为Kw,下列说法正确的是( )| A. | 常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 常温下,在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L | |
| C. | 若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=$\sqrt{Kw}$ |
分析 A.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒判断c(Cl-)、c(NH4+)相对大小;
B.常温下,在pH=11的溶液显碱性,水电离出的氢离子和氢氧根离子浓度为10-11;
C.温度不定,无法确定中和之前酸、碱的pH之和;
D.混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度,根据水的离子积常数计算氢离子浓度.
解答 解:A.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒得c(Cl-)=c(NH4+),故A错误;
B.常温下,在pH=11的溶液显碱性,水电离出的氢离子和氢氧根离子浓度为10-11mol/L,碱溶液中氢氧根离子浓度等于10-3mol/L,故B错误;
C.若强酸、强碱中和后溶液的pH=7,温度不知溶液不一定为中性,故C错误;
D.混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度,则反应后溶液中c(H+)=$\sqrt{Kw}$,故D正确;
故选D.
点评 本题考查了弱电解质的电离、酸碱反应后溶液酸碱性判断、注意要根据溶质来确定水电离出氢氧根离子浓度,题目难度中等.

练习册系列答案
相关题目
8.等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合液中有关离子的浓度应满足的关 系是( )
| A. | [M+]>[OH-]>[A-]>[H+] | B. | [M+]>[A-]>[H+]>[OH-] | C. | [M+]>[A-]>[OH-]>[H+] | D. | [M+]>[H+]=[A-]>[OH-] |
5.将等物质的量的SO2、Cl2通入水中,所得的溶液( )
| A. | 具有中性漂白性 | B. | 具有酸性漂白性 | C. | 只有漂白性 | D. | 只有酸性 |
3.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液500mL | 准确称取氯化钾固体,放入到500mL的容量瓶中,加水溶解、振荡、摇匀、定容 |
| C | 闻氯气的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
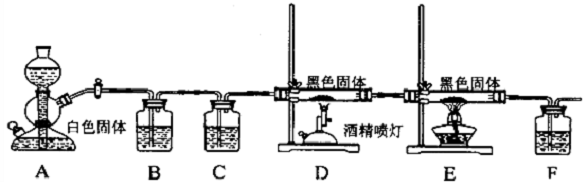
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容. 如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题:
如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题: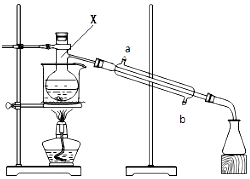 如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:
如图所示的装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层: 2016中国首艘国产航母即将竣工,8艘052D驱逐舰下水,加快了我国海军迈向“蓝水海军”的步伐.
2016中国首艘国产航母即将竣工,8艘052D驱逐舰下水,加快了我国海军迈向“蓝水海军”的步伐. .
.