题目内容
8.等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合液中有关离子的浓度应满足的关 系是( )| A. | [M+]>[OH-]>[A-]>[H+] | B. | [M+]>[A-]>[H+]>[OH-] | C. | [M+]>[A-]>[OH-]>[H+] | D. | [M+]>[H+]=[A-]>[OH-] |
分析 MOH为强碱,HA为弱酸,等体积等浓度混合恰好生成MA,为强碱弱酸盐,水解显碱性,以此来解答.
解答 解:MOH为强碱,HA为弱酸,等体积等浓度混合恰好生成MA,为强碱弱酸盐,A-水解显碱性,则[M+]>[A-]、[OH-]>[H+],且显性离子大于隐性离子,则离子浓度关系为[M+]>[A-]>[OH-]>[H+],
故选C.
点评 本题考查离子浓度大小的比较,为高频考点,把握混合后溶液中的溶质、盐类水解为解答的关键,侧重分析与应用能力的考查,注意显性离子大于隐性离子,题目难度不大.

练习册系列答案
相关题目
15.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则该元素位于周期表中( )
| A. | 第四周期第ⅢA族 | B. | 第四周期第ⅦA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅣB族 |
13.常温下,水的离子积为Kw,下列说法正确的是( )
| A. | 常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 常温下,在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L | |
| C. | 若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=$\sqrt{Kw}$ |
20.把金属铁加入氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余,则( )
| A. | 溶液中有Fe2+、Cu2+ | B. | 溶液中有Fe3+、Fe2+ | ||
| C. | 剩下的固体是Fe | D. | 溶液中不含Fe3+、Cu2+ |
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,16 g O3所含的氧原子数目为NA | |
| B. | 1 mol•L-1CaCl2溶液中含有的Cl-数目为2NA | |
| C. | 5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA | |
| D. | 标准状况下,22.4 L苯含有的分子数目为NA |
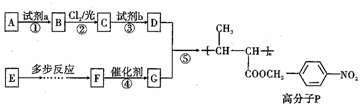
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$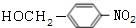 +NaCl.
+NaCl.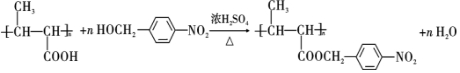 .
.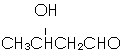 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线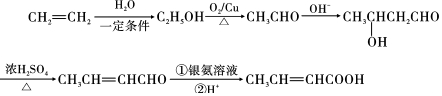 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).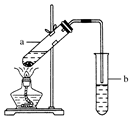 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题: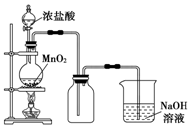 实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示: