题目内容
6.下列说法正确的是( )| A. | 将盐酸和醋酸钠溶液混合后溶液至中性,溶液中c(Na+)=c(Cl-) | |
| B. | 1 mol CH4分子中含有的共价键数目等于1 mol Na2O2固体中含有的离子总数 | |
| C. | 80℃的纯水的pH大于25℃的纯水的pH | |
| D. | 等体积、等pH的盐酸和醋酸与1mol/L的NaOH溶液完全中和,消耗的NaOH溶液体积后者多 |
分析 A.溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断;
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol;
C.水的电离是吸热反应,升高温度促进水的电离;
D.氯化氢为强电解质,醋酸为弱电解质,二者都是一元酸,pH值相等,则醋酸的浓度远远大于盐酸,结合氢氧化钠与醋酸、盐酸反应比例关系解答;
解答 解:A.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)>c(Cl-),故A错误;
B.1molCH4分子中含有4mol共价,1 mol Na2O2固体中含有的离子总数为3mol,二者数目不相等,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的电离程度越大,则水的pH越小,所以80℃的纯水的pH小于25℃的纯水的pH,故C错误;
D.氯化氢为强电解质,醋酸为弱电解质,二者都是一元酸,中和氢氧化钠能力相当,等体积、等pH的盐酸和醋酸,醋酸浓度远远大于盐酸,所以氯化氢的物质的量小于醋酸,消耗氢氧化钠的体积醋酸多,故D正确;
故选:D.
点评 本题考查了弱电解质的电离,根据弱电解质的电离影响因素、物质的结构、盐类水解等知识点来分析解答,注意电荷守恒的应用,注意水电离平衡的影响因素,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列各组物质中,只用一种试剂不能鉴别的是( )
| A. | 苯酚溶液、乙醇、己烯、四氯化碳 | B. | 甲酸、乙酸、乙醛、乙醇 | ||
| C. | 淀粉溶液、乙醇、苯、四氯化碳 | D. | 苯、甲苯、己烯、溴苯 |
11.某溶液能与铝反应生成氢气,则该溶液中一定不能够大量共存的离子组是( )
| A. | NH4+、K+、Ba2+、Cl- | B. | Na+、K+、Cl-、S2- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Na+、SO32-、NO3- |
18.常温下,向20mL 0.5mol•L-1的CH3COOH溶液中逐滴滴加0.5mol•L-1的NaOH溶液,滴定曲线如图.相关分析正确的是( )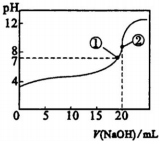

| A. | 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应 | |
| B. | 滴加至②时,c(OH-)-c(H+)=c(CH3COOH) | |
| C. | 滴定中,$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$逐渐减小 | |
| D. | 滴定中.c(CH3COOH)与c(CH3 C00-)之和保持不变 |
15.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
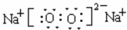 ,ED4的电子式是
,ED4的电子式是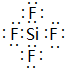 ;
;