题目内容
3.下列说法正确的是( )| A. | 合成氨反应中,断开1molN≡N键,同时生成6molN-H键,达化学平衡状态 | |
| B. | 有气体参与的可逆反应中,当反应容器中的压强保持不变时,达到化学平衡状态 | |
| C. | 当反应物或生成物在混合物中的百分含量保持不变时,即达到化学平衡状态 | |
| D. | 工业生产中采用高温是因为高温下反应物的转化率比低温时高 |
分析 A、正逆反应速率相等的状态是平衡状态;
B、有气体参与的可逆反应中,反应前后气体的系数和相等的反应,压强不会引起平衡的变化;
C、化学平衡状态的特征:定:反应物或生成物在混合物中的百分含量保持不变;
D、根据升高温度化学平衡向着吸热方向进行来判断.
解答 解:A、合成氨反应中,断开1molN≡N键,同时生成6molN-H键,正逆反应速率不一定相等,所以不一定达到平衡,故A错误;
B、有气体参与的可逆反应中,当反应容器中的压强保持不变时,不一定达到化学平衡状态,如反应前后气体的系数和相等的反应,故B错误;
C、当反应物或生成物在混合物中的百分含量保持不变时的状态是化学平衡状态,故C正确;
D、对于吸热反应,升高温度,平衡正向移动,此时高温下反应物的转化率比低温时高,但是对于吸热反应正好相反,故D错误.
故选C.
点评 本题涉及化学平衡状态的判断以及影响化学平衡移动的因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
11.称四份0.50g锌,按下列要求分别盛于四支试管里,塞上带导管的塞子,每隔一段时间分别测定生成氢气的体积.
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
| A. | 生成氢气的速率从快到慢为④③②① | |
| B. | 四组实验反应完全后生成氢气的总量相等 | |
| C. | 四组实验反应完全后锌均无剩余 | |
| D. | 四组实验反应完全后所得的硫酸锌的物质的量相同 |
18.在约100℃的温度下,NaCl稀溶液中[H+]为1×10-6 mol•L-1.下列说法中正确的是( )
| A. | 该NaCl溶液显酸性 | |
| B. | 该NaCl溶液显中性 | |
| C. | 该NaCl溶液中KW=1×10-14 mol2•L-2 | |
| D. | 该NaCl溶液中KW=1×10-12 mol2•L-2 |
8.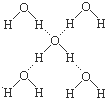 下列有关冰的说法中,正确的组合是( )
下列有关冰的说法中,正确的组合是( )
①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④冰的结构是由氢键的方向性和饱和性所决定的;
⑤冰中H和O原子之间的作用力不是σ键就是氢键
⑥每个水分子平均拥有四个氢键.
 下列有关冰的说法中,正确的组合是( )
下列有关冰的说法中,正确的组合是( )①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④冰的结构是由氢键的方向性和饱和性所决定的;
⑤冰中H和O原子之间的作用力不是σ键就是氢键
⑥每个水分子平均拥有四个氢键.
| A. | 除⑥外 | B. | 除④外 | C. | 除④⑤⑥外 | D. | 全对 |
12.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性:HCl>HBr>HI | D. | 非金属性:F>O>S |

 .
.