题目内容
10.(1)相同质量的SO2、SO3的物质的量之比为5:4;氧原子的个数之比为5:6.(2)22.2g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是111g/mol;A的相对原子质量是40;ACl2的化学式是CaCl2.
分析 (1)根据n=$\frac{m}{M}$知,相同质量的SO2、SO3的物质的量之比等于二者的摩尔质量反比,再结合分子构成计算O原子个数之比;
(2)每个氯化物化学式中含有2个氯离子,所以n(ACl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,M=$\frac{m}{n}$,摩尔质量在数值上等于其相对分子质量,根据A的相对分子质量确定A元素.
解答 解:(1)根据n=$\frac{m}{M}$知,相同质量的SO2、SO3的物质的量之比等于二者的摩尔质量反比=80g/mol:64g/mol=5:4,每个SO2、SO3分子中O原子个数分别是2、3,所以O原子总数之比=(5×2):(4×3)=5:6,
故答案为:5:4;5:6;
(2)每个氯化物化学式中含有2个氯离子,所以n(ACl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,M=$\frac{m}{n}$=$\frac{22.2g}{0.2mol}$=111g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为111,A的相对原子质量=111-35.5×2=40,则A是Ca元素,其化学式为CaCl2,
故答案为:111 g•mol-1;40;CaCl2.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系及分子构成是解本题关键,注意氯化钙中氯离子和氯化钙的关系,题目难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
15.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 若某个化学反应中,反应物的总能量高于生成物的总能量,则该反应为放热反应 |
2.实现下列变化时,需要克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 液溴和液汞的汽化 | D. | 氨的气化和水的电离 |
19.硫元素的价电子较多,与氯能形成多种化合物.将Cl2通入熔融的硫磺可以制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊;而S2Cl2与NaOH 溶液反应可生成三种盐,得到澄清溶液.S2Cl2在合成橡胶,硬水软化等方面有着重要应用.有关S2Cl2的叙述正确的有( )
| A. | S2Cl2的结构简式:S-Cl-S-Cl | |
| B. | 13.5g S2Cl2和NaOH反应电子转移数为0.1NA | |
| C. | S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 | |
| D. | S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
20.已知在101KPa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2;△H(298K)=-242kJmol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H(298K)=+484kJmol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-242kJmol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-484kJ |

 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.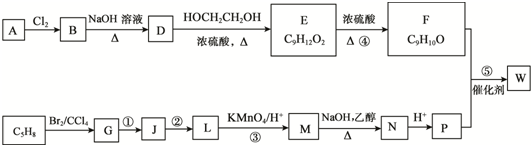
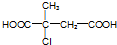 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.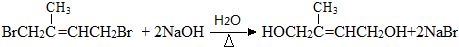 .
. .
. .
.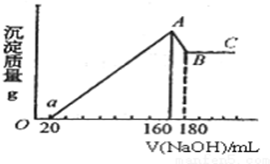 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.