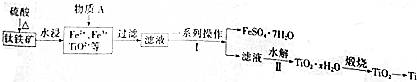
题目内容
10.下列反应的离子方程式书写正确的是( )| A. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯化亚铁溶液中通入少量氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
分析 A.反应生成氯化亚铁和氢气;
B.电子、电荷不守恒;
C.反应生成偏铝酸钠和水;
D.一水合氨在离子反应中保留化学式.
解答 解:A.铁粉与过量的稀盐酸的反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.氯化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.氧化铝与氢氧化钠溶液反应的离子反应为Al2O3+2OH-=2AlO2-+H2O,故C正确;
D.氯化铝溶液中加入过量的氨水反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
2.下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH.某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是( )
| 金属离子 | Fe2+ | Fe3+ | Zn2+ |
| 完全沉淀时的pH | 7.7 | 4.5 | 6.5 |
| A. | H2O2、ZnO | B. | 氨水 | C. | KMnO4、ZnCO3 | D. | NaOH溶液 |
19.在25℃,101kPa下,0.1molC2H2完全燃烧生成CO2和H2O(I)时放出129.96kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ | |
| B. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)-259.92kJ | |
| C. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)-1299.6kJ | |
| D. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ |
20.某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( )
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe5O7 |

 .
. 汽车安全气囊一般由传感器、气囊、气体发生器等组成.
汽车安全气囊一般由传感器、气囊、气体发生器等组成.